
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3===N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子______________________________________________________________________________。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是______________________________________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式________________________________________________________________。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为______________________;F的烧杯所起的作用是________________________________________________________________。
科目:高中化学 来源: 题型:实验题
下图是研究铜与浓硫酸的反应装置:

(1)A试管中发生反应的化学方程式为 。
(2)反应一段时间后,可观察到B试管中的现象为 。
(3)C试管口浸有NaOH溶液的棉团作用是 。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是 、 。(要求填一种化合物和一种单质的化学式;如有需要,可加装防倒吸装置。)
(5)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是 。
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
仅由
| 资料1 |  附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。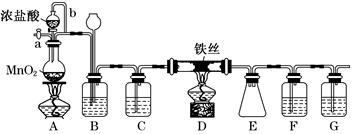
请回答:
(1)装置A中反应的离子方程式为__________________________________________。
(2)装置F中所加的试剂为_________________________________________________。
(3)导管b的作用为_____________________________________________________;
装置B的作用为________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为_______________________________________________________。
(5)反应结束后,拆卸装置前,必须进行的操作是_________________________________
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为________(填序号)。
①Fe粉 ②KSCN溶液 ③酸性KMnO4溶液 ④NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告。
| 物质 | 类别 | 化学性 质预测 | 实验验证 | ||
| 实验操作 | 实验现象 | 实质(用离子 方程式表示) | |||
| 二氧 化硫 | 酸性 氧化物 | 与水 反应 | 将盛满SO2气体的试管倒立在水中,并测定试管中溶液的pH | ① | SO2+H2O H2SO3 H2SO3 |
| 与碱 反应 | ② | 出现白 色沉淀 | ③ | ||
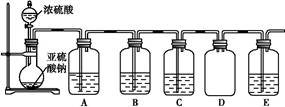
| 装置 | 药品 | 作用 |
| A | | 验证二氧化硫的还原性 |
| B | | |
| C | 品红溶液 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题: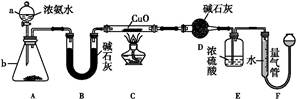
(1)仪器a的名称为 ;仪器b中可选择的试剂为 。
(2)实验室中,利用装置A,还可制取的无色气体是 (填字母)。
| A.Cl2 | B.O2 | C.CO2 | D.NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl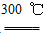 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点-33 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下图(热源及夹持装置略去)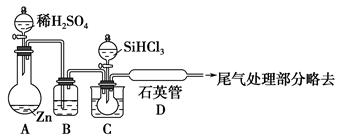
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是___________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是__________________________________________________。
装置D中发生反应的化学方程式为____________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________________________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是(填写字母代号)________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
它们制备SO2和Cl2所依据的原理分别是:
Na2SO3+H2SO4= Na2SO4+H2O+SO2↑ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)用来制取Cl2的装置是 (填序号),反应中浓盐酸所表现出的化学性质是 和
(2)反应开始一段时间后, B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,____ __ (填“B”或“D” )试管中无明显现象。
(3)装置C的作用是 ;
(4) 若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是 。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。反应一段时间后,停止加热。回答下列问题: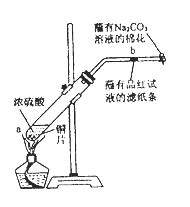
(1)写出a处反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)待试管中的液体冷却后,将试管上层液体倒去,再将剩余物质慢慢加入水中,可观察溶液呈 色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是 ,反应的化学方程式为 。
(5)若用浓度为18 mol/L的浓硫酸100 mL与过量的铜片,加热使之反应,则被还原的硫酸(选填“大于”、“等于”或“小于”) 0.9 mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组用下列装置抽取收集纯净的氯气,并研究其性质。请回稳下列问题。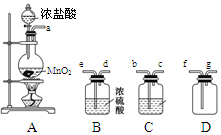
(1)装置A中发生反应的离子方程式为_______________________________。
(2)按照气流方向各仪器接口的连接顺序为a→___________________→g。
(3)装置B中浓硫酸的作用是____________________________________________________________,装置C的试剂最好是___________________________________。
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂。
| |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com