
| X | Y | ||
| Z | W | Q |
| A. | 最高正价X>Z | B. | 原子半径X>Q | C. | 单质熔点Y>Q | D. | 阴离子还原性Y>W |
分析 由短周期主族元素X、Y、Z、W、Q在元素周期表的位置,可知X、Y为第二周期元素,Z、W、Q为第三周期元素.
A.X的族序数比Z的族序数大1;
B.电子层越多,原子半径越大;
C.Y、Q一定为同主族的非金属,若均为ⅤⅡA族元素,对应单质的相对分子质量越大,熔点越大;
D.非金属性越强,对应离子的还原性越弱.
解答 解:由短周期主族元素X、Y、Z、W、Q在元素周期表的位置,可知X、Y为第二周期元素,Z、W、Q为第三周期元素.
A.X的族序数比Z的族序数大1,族序数=最外层电子数=最高正价,且X一定不是O、F,则最高正价X>Z,故A正确;
B.电子层越多,原子半径越大,则原子半径X<Q,故B错误;
C.Y、Q一定为同主族的非金属,若均为ⅤⅡA族元素,对应单质的相对分子质量越大,熔点越大,则单质熔点Y<Q,故C错误;
D.非金属性Y>W,对应离子的还原性为Y<W,故D错误;
故选A.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质及元素周期律等为解答的关键,侧重分析与应用能力的考查,注意选项C中熔点比较规律,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
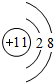 ,C的原子结构示意图为
,C的原子结构示意图为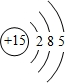 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
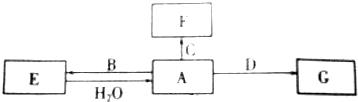
 ,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
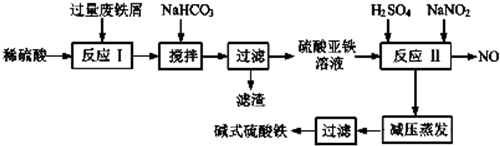
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
| A.酸性KMnO4溶液 B.KSCN溶液 | C.氯水 D.NaOH溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石头纸(主要成分CaCO3)代替普通纸,减少对木材的使用 | |
| B. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺的状况 | |
| C. | 将秸秆充分燃烧,避免秸秆腐烂造成环境污染 | |
| D. | 推广碳捕集和储存技术,逐步实现二氧化碳零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ,其阴、阳离子的个数之比为1:2.
,其阴、阳离子的个数之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
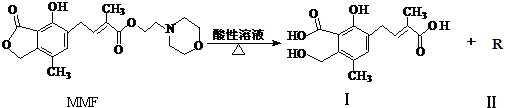
| A. | MMF分子中含有三种官能团 | |
| B. | 可以用NaHCO3溶液区别MMF与化合物Ⅰ | |
| C. | 化合物Ⅱ分子中只含碳、氢元素,属于烃类 | |
| D. | 1 mol MMF与足量NaOH 溶液共热,最多可消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②和③ | C. | ④ | D. | ①和④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com