
| 化学键 | C-C | C-H | H-H | C-O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 463 |
| A. | 1550+43.2kJ•mol-1 | B. | 750-43.2kJ•mol-1 | ||
| C. | 1550+86.4kJ•mol-1 | D. | 750+43.2kJ•mol-1 |
分析 根据反应焓变=反应物键能之和-生成物键能之和计算,二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ;结构式为O=C=O,设C═O的键能为x,依据①求算断开1molC═O需要吸收的能量,根据已知方程式构建目标方程式,根据盖斯定律求算CO(g)+2H2(g)═CH3OH(g)的反应热.
;结构式为O=C=O,设C═O的键能为x,依据①求算断开1molC═O需要吸收的能量,根据已知方程式构建目标方程式,根据盖斯定律求算CO(g)+2H2(g)═CH3OH(g)的反应热.
解答 解:二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ;结构式为O=C=O,设C═O的键能为x,①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-178kJ•mol-1,反应焓变△H=反应物键能之和-生成物键能之和=2x+3×436-(3×413+358+463)-(2×463)=-178kJ,解得x=750kJ,即断开1molC═O需要吸收的能量为750kJ,
;结构式为O=C=O,设C═O的键能为x,①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-178kJ•mol-1,反应焓变△H=反应物键能之和-生成物键能之和=2x+3×436-(3×413+358+463)-(2×463)=-178kJ,解得x=750kJ,即断开1molC═O需要吸收的能量为750kJ,
已知①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-178kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-41.2kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
将①+(②-③)×$\frac{1}{2}$得:CO(g)+2H2(g)═CH3OH(g)根据盖斯定律可得△H=(-178kJ•mol-1)+[(-41.2kJ•mol-1)-(-483.6kJ•mol-1)]×$\frac{1}{2}$=+43.2kJ•mol-1,
故选D.
点评 本题考查了焓变的计算应用,掌握反应焓变为反应物键能之和-生成物键能之和是解题关键,注意二氧化碳的结构,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | 除短周期外,其他周期均有18种元素 | |
| D. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

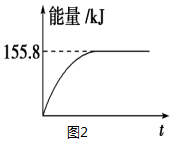
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
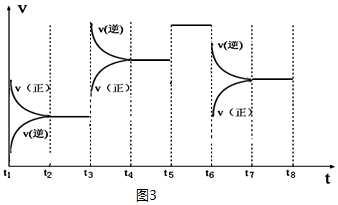
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的平衡浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=92.4 | C. | 2p2>p3 | D. | α1+α3<1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
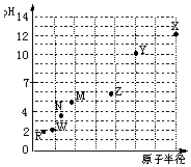 同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )| A. | 气态氢化物的稳定性:M>N | |
| B. | Z的最高价氧化物能溶于稀氨水 | |
| C. | X和W形成的常见化合物中阴、阳离子个数比为2:1 | |
| D. | Z和R的简单离子半径:Z3+<R- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b)-58.7 | I2-184.0 |
| ③ | (e)-19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O-100.0 | H2S-60.0 | (d)-42 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | a、b、c的化学式分别为Ne2、Br2、HF | |
| B. | 第②组物质均有氧化性;第③组物质对应水溶液均是强酸 | |
| C. | 第④组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te | |
| D. | 上表中同族物质对应的氢化物的沸点,均随相对分子质量的增大而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方案 | 预测实验现象 | 相应结论 | |
| A | 向酸性Fe(NO3)3溶液通入少量H2S | 有黄色沉淀 | Fe(NO3)3中铁元素具有氧化性 |
| B | CH3CH2Br与NaOH乙醇共热后将气体通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | CH3CH2Br与NaOH乙醇溶液共热生成乙烯 |
| C | 测定相同条件下等物质的量浓度的CH3COONa、NaHCO3的pH | NaHCO3溶液的pH大 | 酸性:碳酸<乙酸 |
| D | 10mL0.1mol/L的NaOH溶液滴入2mL等浓度的MgCl2溶液,然后再滴加FeCl3溶液 | 先出现白色沉淀,后沉淀变为红褐色 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com