
 +2H2C=CH2
+2H2C=CH2| 一定条件 |
 +2H2C=CH2
+2H2C=CH2| 一定条件 |
| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
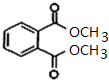 ,C是CH2=CHCH2OH,A被酸性高锰酸钾氧化然后发生酯化反应生成D,则A结构简式为
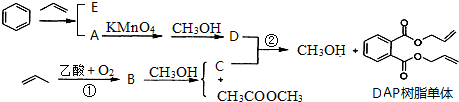
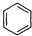
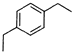
,C是CH2=CHCH2OH,A被酸性高锰酸钾氧化然后发生酯化反应生成D,则A结构简式为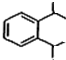 ,苯和丙烯发生加成反应生成E,E的相对分子质量为162,1H核磁共振有3个信号,苯和丙烯发生对位加成,其结构简式为
,苯和丙烯发生加成反应生成E,E的相对分子质量为162,1H核磁共振有3个信号,苯和丙烯发生对位加成,其结构简式为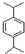 ,B和甲醇反应生成丙烯醇和乙酸甲酯,则B的结构简式为CH3COOCH2CH=CH2,再结合题目分析解答.
,B和甲醇反应生成丙烯醇和乙酸甲酯,则B的结构简式为CH3COOCH2CH=CH2,再结合题目分析解答. ,C是CH2=CHCH2OH,A被酸性高锰酸钾氧化然后发生酯化反应生成D,则A结构简式为
,C是CH2=CHCH2OH,A被酸性高锰酸钾氧化然后发生酯化反应生成D,则A结构简式为 ,苯和丙烯发生加成反应生成E,E的相对分子质量为162,1H核磁共振有3个信号,苯和丙烯发生对位加成,其结构简式为
,苯和丙烯发生加成反应生成E,E的相对分子质量为162,1H核磁共振有3个信号,苯和丙烯发生对位加成,其结构简式为 ,B和甲醇反应生成丙烯醇和乙酸甲酯,则B的结构简式为CH3COOCH2CH=CH2,
,B和甲醇反应生成丙烯醇和乙酸甲酯,则B的结构简式为CH3COOCH2CH=CH2, ,故答案为:
,故答案为: ;
;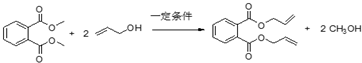 ,
, ;
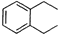
; ,D的同分异构体符合下列条件,能与NaOH溶液反应说明含有羧基、酯基或酚羟基,苯环上只有两个相同的取代基,且苯环上的一氯代物有两种,说明两个取代基位于相邻位置,且都是羧基或酯基,符合条件的同分异构体有
,D的同分异构体符合下列条件,能与NaOH溶液反应说明含有羧基、酯基或酚羟基,苯环上只有两个相同的取代基,且苯环上的一氯代物有两种,说明两个取代基位于相邻位置,且都是羧基或酯基,符合条件的同分异构体有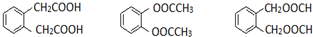 ,
,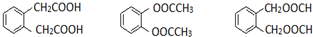 ;
;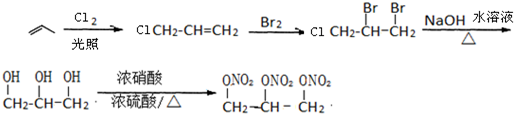 ,或者丙烯和氧气、乙酸反应生成乙酸丙烯酯,乙酸丙烯酯和溴发生加成反应生成CH3COOCH2CHBrCH2Br,CH3COOCH2CHBrCH2Br在加热条件下和氢氧化钠的水溶液发生取代反应生成甘油,然后发生硝化反应生成硝化甘油,其流程图为
,或者丙烯和氧气、乙酸反应生成乙酸丙烯酯,乙酸丙烯酯和溴发生加成反应生成CH3COOCH2CHBrCH2Br,CH3COOCH2CHBrCH2Br在加热条件下和氢氧化钠的水溶液发生取代反应生成甘油,然后发生硝化反应生成硝化甘油,其流程图为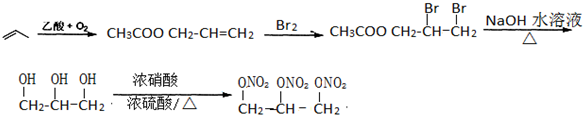 ,
, 或
或 .
.


科目:高中化学 来源: 题型:
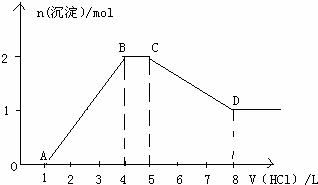
| 阴离子种类 | |||||
| 物质的量浓度(mol/L) |
查看答案和解析>>
科目:高中化学 来源: 题型:
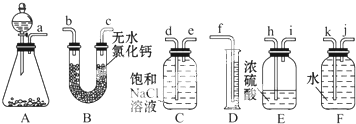
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2溶液和稀H2SO4 |
| B、NH4Cl溶液和NaOH溶液 |
| C、K2CO3溶液和稀H2SO4 |
| D、KI溶液和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
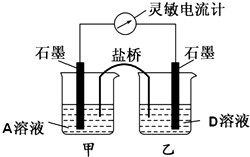 四种强电解质A、B、C、D的溶液,分别含有下列阴阳离子的各一种,且不重复.已知A溶液为黄色,含0.01mol的A溶液与含0.01mol的B溶液反应生成白色沉淀,再逐滴加入D溶液,白色沉淀最后转变为黄色沉淀.将C溶液滴在pH试纸的中部,显蓝色.
四种强电解质A、B、C、D的溶液,分别含有下列阴阳离子的各一种,且不重复.已知A溶液为黄色,含0.01mol的A溶液与含0.01mol的B溶液反应生成白色沉淀,再逐滴加入D溶液,白色沉淀最后转变为黄色沉淀.将C溶液滴在pH试纸的中部,显蓝色.| 阳离子 | K+、Fe3+、Ag+、Ca2+ |
| 阴离子 | Cl-、I-、CO32-、NO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
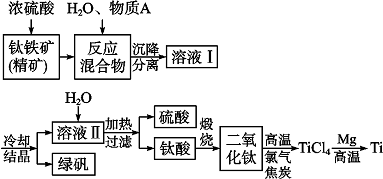
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
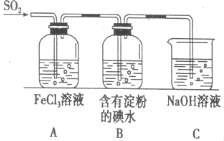 SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com