
亚硝酸(HNO2)在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,其还原产物可能是( )
①NO ②NO2 ③HNO3 ④N2 ⑤NH3
A.①③ B.①②④
C.①④⑤ D.全部
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
下列实验方案中,不能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中, |
| D | 验证Fe(OH)3的溶解度小于Mg(OH) | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有机物A—F具有如下的转化关系。根据要求填空:
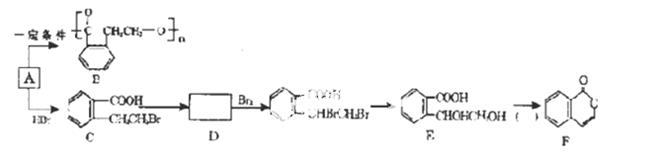
(1)A中的含氧官能团有___________________(写名称),A的分子式为______________。
(2)A转化生成B 的反应类型是_________________。
的反应类型是_________________。
(3)C转化生成D的试剂和条件_________________。
(4)F在酸性条件下水解的化学方程式为_________________。
(5)A的同分异构体R,具有如图所示的性质。请写出符合条件的R的同分异构体的结构简式(任写两种)。

查看答案和解析>>
科目:高中化学 来源: 题型:
中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。该转化关系中A可能是下列物质中的几种
①金属钠②硫单质③NH3④Na2CO3⑤NH4Cl
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
掌握物质之间的转化,是学习元素化合物知识的基础。
(I)(1)中学常见的某反应的化学方程式为:
A+B→C+D+H2O(未配平,反应条件略去)。
若C、D均为气体,且都能使澄清石灰水变浑浊。
①请写出该反应的化学方程式____________;
②某探究性学习小组利用右图中所列装置实验,证明上述反应中有C、D生成。则b瓶溶液的作用是_________,该溶液还可以用_____________试剂代替。
③装置d中所盛溶液是__________。
(II)下列框图所示的物质转化关系中,甲、乙、丙是常见的气体单质。气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略
 去)。
去)。
请回答下列问题:
(1)写出C的电子式:___________________________。
(2)E是_______化合物(填“共价”或“离子”,含有的化学键为__________________。
(3)写出B和丙生成A的离子反应方程式_________________________________________。
(4)工业上可用C的浓溶液吸收某些工厂尾气中的SO2,写出反应成酸式盐的离子方程式:
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息判断,下列选项不正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO | Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO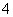 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2 O2===2Na2FeO4+2Na2O+2
O2===2Na2FeO4+2Na2O+2 +O2↑。下列对此反应的说法中,不正确的是 ( )
+O2↑。下列对此反应的说法中,不正确的是 ( )
A.方框中的物质为Na2SO4
B.Na2O2既是氧化剂,又是还原剂
C.Na2FeO4既是氧化产物,又是还原产物
D.2 mol FeSO4发生反应时,反应中共转移8 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第 周期、第 族;PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
 (3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2 和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2 和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
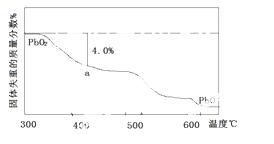
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2 ·nPbO,列式计算x值和m:n值 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式的书写正确的是 ( )
A.CuCl2 = Cu + Cl2↑ B.Na2CO3 = 2Na+ + CO32-
C.H2SO4=2H+ + S6+ + 4O2- D.Ba(OH)2 = Ba + 2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com