
【题目】在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是
A.n(Cl2)∶n(Fe)=5∶4;5Cl2+4Fe![]() 2FeCl2+2FeCl3
2FeCl2+2FeCl3
B.n(Cl2)∶n(FeBr2)=1∶1;Fe2++2Br+Cl2=Fe3++Br2+2Cl
C.n(MnO4-)∶n(H2O2)=2∶3;2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.n(Fe) ∶n[HNO3(稀)]=1∶3;4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O
【答案】D
【解析】
A.Fe与氯气反应与量无关,对应反应为3Cl2+2Fe![]() 2FeCl3,A错误;
2FeCl3,A错误;
B. n(Cl2)∶n(FeBr2)=1∶1,Fe2+全部被氧化为Fe3+,Br-有一半被氧化为Br2,对应离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,B错误;
C. n(MnO4-)∶n(H2O2)=2∶3时,不遵循电子守恒,则n(MnO4-):n(H2O2)=2:5时对应离子反应为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,C错误;
D.n(Fe) ∶n[HNO3(稀)]=1∶3,由电子守恒可知,生成Fe2+和Fe3+,NO3-被还原产生NO气体,结合电荷守恒及原子守恒,可得离子反应为4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O,D正确;
故合理选项是D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:
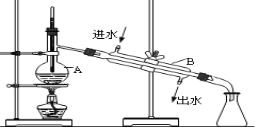
(1)装置中仪器A、B的名称是_____________________ 、 ______________________。
(2)请指出上图中的两处明显错误:____________________、_____________________。
(3)实验时A中除加入少量自来水外,还需加入少量的沸石,其作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的且操作正确的是( )
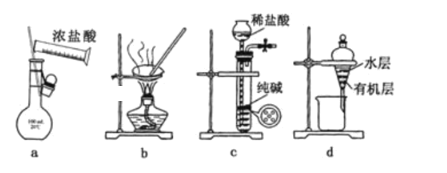
A.用图a所示装置配制l00mL0.100mo1L-1稀盐酸
B.用图b所示装置蒸发NaCl溶液制备NaCl固体
C.用图c所示装置制取少量CO2气体
D.用图d所示装置分离用苯萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含氢原子为0.2×6.02×1024个的NH4HCO3,其质量是___,其中含氧原子的物质的量为___。3.6克水中含有质子数为___(阿伏伽德罗常数为NA)。
(2)现实验室要用12mol·L-1氢氧化钠溶液来配制浓度为0.6mol·L-1的稀氢氧化钠溶液100mL,则需要这种浓碱的体积是___mL。需要用托盘天平称量___克氢氧化钠才能配制成0.5mol·L-1的氢氧化钠溶液100mL。
(3)将标况下aLHCl气体溶于配制成1L盐酸溶液,所得溶液密度为dg/cm3,则所得溶液物质的量浓度为___mol/L,该溶液中溶质的质量分数为___。
(4)在标准状况下,某气体A的密度是1.25g·L-1,则它的摩尔质量是___,同温同压下该气体相对于氢气的密度是___;在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,此混合气体的平均相对分子质量是___,混合物中CO和CO2物质的量之比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A. HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. H2SO4的电离方程式H2SO4![]() 2H++SO42-
2H++SO42-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧杯中盛有含0.2 mol NH4Al(SO4)2的溶液,向其中缓缓加入4 mol·L-1的NaOH溶液200 mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
A. Al3+和Al(OH)3 B. AlO2— C. AlO2—和Al(OH)3 D. Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 0.1mo1·L-1 的 H2SO4 溶液中滴入 0.1mo1·L-1 过量的 Ba(OH)2 溶液,溶液的导电能力发生变化,其电流强度 (I) 随加入 Ba(OH)2 溶液的体积 (V) 的变化曲线正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中的物质有HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
(1)①写出未配平的该反应的化学方程式:____→___
②在该反应中,得电子的物质是___,被氧化的元素是___。
③在反应中,每转移1 mol电子,消耗HCl___mol。
④下列叙述中正确的是___(填写字母序号)。
a.在相同条件下,第ⅦA族元素的阴离子的还原性从上到下逐渐增强
b.得电子越多的氧化剂,其氧化性越强
c.阳离子只能作氧化剂
d.在相同条件下,氧化性顺序:Fe3+>Cu2+>H+>Fe2+
(2)①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。该反应的离子方程式为__,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。该反应的化学方程式为___。
②把KI换成KBr,则CCl4层变为____色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____。
③加碘盐中含碘量为20mg·kg-1~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2____L(标准状况,保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最小
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com