
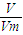 来计算气体的物质的量,利用m=n×M来计算气体的质量,溶剂和溶质的质量和为溶液的质量,利用V=
来计算气体的物质的量,利用m=n×M来计算气体的质量,溶剂和溶质的质量和为溶液的质量,利用V=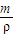 来计算溶液的体积,最后利用c=
来计算溶液的体积,最后利用c=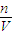 来计算该溶液的物质的量浓度;
来计算该溶液的物质的量浓度;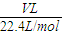 =
=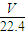 mol,气体的质量为
mol,气体的质量为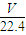 mol×36.5 g?mol-1=
mol×36.5 g?mol-1=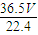 g,水的质量为1000mL×1g/mL=1000g,即溶液的质量为=
g,水的质量为1000mL×1g/mL=1000g,即溶液的质量为= g+1000g,则溶液的体积为
g+1000g,则溶液的体积为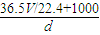 ×10-3L,
×10-3L,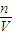 =
=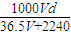 mol?L-1,
mol?L-1,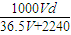 mol?L-1;
mol?L-1;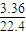 mol=0.15mol
mol=0.15mol

科目:高中化学 来源: 题型:
| 1000Vd |
| 36.5V+2240 |
| 1000Vd |
| 36.5V+2240 |
查看答案和解析>>
科目:高中化学 来源:2013学年江西省德兴一中、横峰中学、铅山一中、弋阳一中高一第三次月考化学试卷(带解析) 题型:填空题
(10分)Ⅰ.已知NaHS04是一种酸式盐,在工业上应用广泛,根据NaHS04的性质回答下列问题:
(1)写出NaHS04在水溶液中的电离方程式:
(2)若向NaHS04溶液中滴加Ba(OH)2至SO42-完全沉淀时的离子方程式为
(3)滴加Ba(0H)2溶液使溶液呈中性时的化学方程式为
Ⅱ.(4)若在标准状况下,将V L HCl气体溶于lL水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为
(5) 一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L(标准状况下)的气体,则该合金中铝、铁的物质的量之比为
查看答案和解析>>
科目:高中化学 来源:2013学年江西省、铅山一中、弋阳一中高一第三次月考化学试卷(解析版) 题型:填空题
(10分)Ⅰ.已知NaHS04是一种酸式盐,在工业上应用广泛,根据NaHS04的性质回答下列问题:
(1)写出NaHS04在水溶液中的电离方程式:
(2)若向NaHS04溶液中滴加Ba(OH)2至SO42-完全沉淀时的离子方程式为
(3)滴加Ba(0H)2溶液使溶液呈中性时的化学方程式为
Ⅱ.(4)若在标准状况下,将V L HCl气体溶于lL水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为
(5) 一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L(标准状况下)的气体,则该合金中铝、铁的物质的量之比为
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
已知NaHS04是一种酸式盐,在工业上应用广泛,根据NaHS04的性质回答下列问题:
(1)写出NaHS04在水溶液中的电离方程式:______
(2)若向NaHS04溶液中滴加Ba(OH)2至SO42-完全沉淀时的离子方程式为______
(3)滴加Ba(0H)2溶液使溶液呈中性时的化学方程式为______
(4)若在标准状况下,将V L HCl气体溶于lL水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为______
(5)一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6L(标准状况下)的气体,则该合金中铝、铁的物质的量之比为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com