
0.1 mol·L-1某碱AOH溶液的pH=11,将该溶液稀释10倍后,溶液的pH不可能为( )
①10.1 ②10.8 ③12 ④11.5
A.③④ B.①②
C.①③ D.②④
科目:高中化学 来源: 题型:
试比较下列各组ΔH的大小。
(1)同一反应,生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
则ΔH1____ΔH2(填“>”、“<”或“=”,下同)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用“酸性”、“碱性”、“中性”或“不确定”填空。
(1)pH<7的溶液( )
(2)pH=7的溶液( )
(3)c(H+)=c(OH-)的溶液( )
(4)c(H+)=1×10-7mol·L-1的溶液( )
(5)c(H+)>c(OH-)的溶液( )
(6)0.1 mol·L-1的NH4Cl溶液( )
(7)0.1 mol·L-1的NaHCO3溶液( )
(8)0.1 mol·L-1的NaHSO3溶液( )
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)测定NaOH溶液浓度,可用滴定管、锥形瓶、烧杯、NaOH溶液、0.100 0 mol·L-1盐酸达到目的( )
(2014·安徽理综,9D)
(2)用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低( )
(2014·大纲全国卷,6D)
(3) ( )
( )
(2014·山东理综,10B)
(4)50 ℃时,pH=4的醋酸中,c(H+)=4.0 mol·L-1( )
(2013·广东理综,12A)
(5)50 ℃时,pH=12的纯碱溶液中,c(OH-)=1.0×10-2 mol·L-1( )
(2013·广东理综,12C)
(6)在蒸馏水中滴加浓硫酸,Kw不变( )
(2013·天津理综,5A)
(7)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )
(2013·天津理综,5D)
(8)25 ℃与60 ℃时,水的pH相等( )
(2012·福建理综,10B)
(9)中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等( )
(2012·福建理综,10C)
(10)用0.200 0 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和( )
(2012·浙江理综,12C)
(11)常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4( )
(2012·浙江理综,12A)
(12)“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用( )
(2011·浙江理综,8C)
查看答案和解析>>
科目:高中化学 来源: 题型:
测定Na2S2O3·5H2O产品纯度
准确称取W g Na2S2O3·5H2O产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O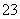 +I2===S4O
+I2===S4O +2I-
+2I-

(5)滴定至终点时,溶液颜色的变化:___________________________。
(6)测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关中和滴定的叙述正确的是( )
A.滴定时,标准液的浓度一定越小越好
B.用盐酸作标准液滴定NaOH溶液时,指示剂加入越多越好
C.滴定管在滴液前和滴液后均有气泡一定不会造成误差
D.滴定时眼睛应注视锥形瓶内溶液的颜色变化而不应注视滴定管内的液面变化
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F代表6种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为__________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为_____。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为____________________________________。
(5)F元素的原子最外层电子排布式为nsnnpn+1,则n=________;原子中能量最高的是________电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
基态硼原子的电子排布式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M如下图(组成E、G、L、M分子的元素原子序数均小于10),则下列判断错误的是( )
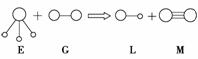
A.G是最活泼的非金属单质
B.L分子内的化学键是极性键
C.E能使紫色石蕊试液变蓝色
D.M化学性质活泼
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com