
| A、元素种类 |
| B、原子个数 |
| C、分子个数 |
| D、反应前后物质的总质量 |
科目:高中化学 来源: 题型:
| A、c (CH3COO-)>c (Na+) |
| B、c (OH-)>c (H+) |
| C、c (CH3COOH)>c (CH3COO-) |
| D、c (CH3COOH)+c (CH3COO-)=0.02mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 性质 元素 | 8O | 16S | 34Se | 52Te |
| 单质溶点(°C) | -218.4 | 113 | 450 | |
| 单质沸点(°C) | -183 | 444.6 | 685 | 989 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在碳化硅(SiC)中硅元素显正价 |
| B、常温下碳酸不稳定,极易分解,硅酸相对稳定 |
| C、在自然界,甲烷比甲硅烷稳定 |
| D、相同条件下,硅酸的酸性低于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4mol KClO3 | ||
B、
| ||
C、
| ||
| D、0.1mol KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

 +CH3COOH→
+CH3COOH→ 聚合物
聚合物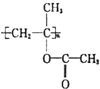 可用于制备高吸水性树脂,其单体的结构简式为
可用于制备高吸水性树脂,其单体的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com