
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】H2S废气资源化的原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1,如图为H2S燃料电池示意图。下列说法正确的是( )
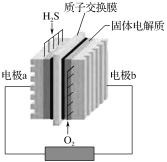
A.电极a为电池的正极
B.电极b上发生的电极反应为:O2+4H++4e-=2H2O
C.电路中每流过4 mol电子,电池会产生632 kJ热能
D.22.4 L H2S参与反应时,2 mol H+经质子交换膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学用下图装置测定氧化铁样品(含![]() 和
和![]() )中
)中![]() 的质量分数,下列说法正确的是( )
的质量分数,下列说法正确的是( )
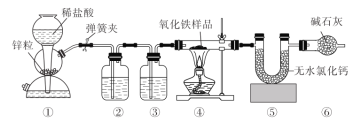
A.实验室用![]() 和浓盐酸制备
和浓盐酸制备![]() 时也可用装置①
时也可用装置①
B.实验开始时先点燃④处酒精灯,再打开弹簧夹
C.装置⑥的作用是吸收④中生成的水蒸气
D.装置②③盛装的试剂分别为![]() 溶液和浓硫酸
溶液和浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为V0且pH相同的MOH与ROH溶液,分别加水稀释至V,pH随![]() 变化如图所示。下列说法正确的是( )
变化如图所示。下列说法正确的是( )
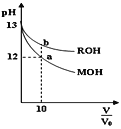
A.MOH为一元强碱
B.a点溶液的导电性大于b点溶液
C.原溶液中:c(MOH)=c(ROH)
D.水的电离程度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
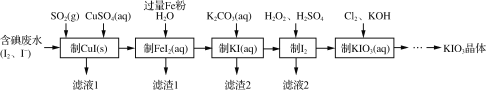
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是______。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为________。
(3)滤渣1的成分为______。(写化学式)
(4)“制KIO3溶液”时,发生反应的离子方程式为___________。
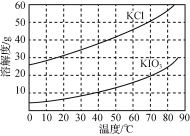
(5)KCl、KIO3的溶解度曲线如图所示。由上述流程中制得的KIO3溶液得到KIO3晶体的方法为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气因热值高、来源广、产物无污染,常被人们看做一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。
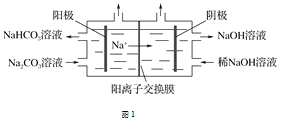
(1)图1为用电解法制备H2,写出阳极的电极反应式:____________________________。
(2)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。下列设想符合研究方向的是________。
A.将研究方向专注于紫外光区,无需考虑可见光区
B.研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料
C.研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料
D.研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=-206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:__________________________________。
(4)利用废弃的H2S的热分解可生产H2:2H2S(g)2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图2所示:
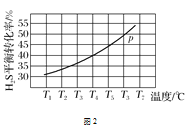
①温度为T4 ℃时,初始体积为1 L,t分钟后,反应达到平衡,该温度下的平衡常数K=________。
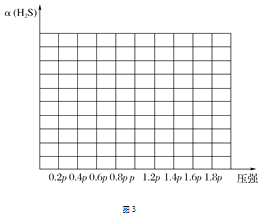
②若保持恒温T ℃,将一定量的H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,试在图3上画出不同起始压强下H2S转化率的趋势图。 _________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图:
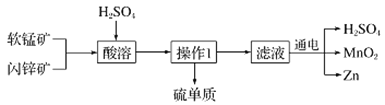
下列说法不正确的是( )
A.干电池是一种将化学能转变为电能的装置
B.酸溶时,ZnS作还原剂,每析出12.8gS沉淀,共转移0.8mol电子
C.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H 前者小于后者的是
①C(s)+O2(g)═CO2(g)△H1 C(s)+![]() O2═CO(g)△H2
O2═CO(g)△H2
②S(g)+O2(g)═SO2(g)△H3 S(s)+O2(g)═SO2(g)△H4
③2H2(g)+O2(g)═2H2O(l)△H5 H2(g)+![]() O2(g)═H2O(l)△H6
O2(g)═H2O(l)△H6
④CaCO3(s)═CaO(s)+CO2(g)△H7 CaO(s)+H2O(l)═Ca(OH)2(s)△H8
A.①④B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多尺度复杂化学系统模型可以用量子化学计算小区间内(如生物固氮时固氮酶中)的化学反应。
(1)固氮酶有铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①乙炔是__________(填“非极性”或“极性”)分子。
②碳负离子CH3-的立体构型为____________。
③根据等电子原理,NO+的电子式为________________。
(2)钒可用于合成电池电极,也可用于人工合成二价的钒固氮酶(结构如图a)。
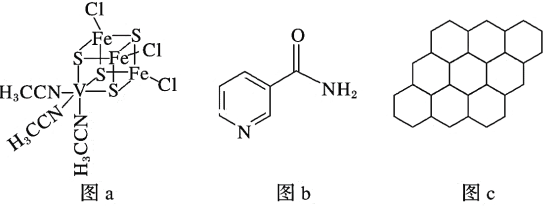
①V2+基态时核外电子排布式为____________________________________________。
②钒固氮酶中钒的配位原子有_____________________________(填元素符号)。
(3)烟酰胺(结构如图b)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有_______________________,1 mol该分子中含σ键的数目为________。
(4)12 g石墨烯(结构如图c)中含有的正六边形数目约为________;请你预测硅是否容易形成类似石墨烯的结构,并说明理由:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com