
| ������ | Mg��OH��2 | Al��OH��3 | Cr��OH��3 |
| ��ȫ������PH | 10.5 | 4.3 | 5.3 |
| ��ʼ�ܽ��pH | -- | 7.8 | 9.2 |
| Ksp����ֵ | 10-12 | 10-14 | 10-31 |
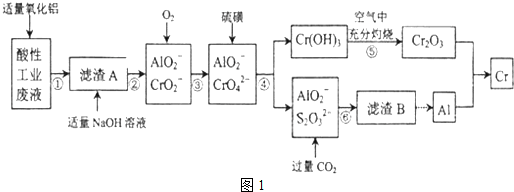
���� �����Թ�ҵ��Һ����H+��Al3+��Mg2+��Cr3+��SO42-���м���Al2O3��������Һ��pHֵ���õ�����AΪ����������������������Һ����Ҫ������þ��Һ������A�м���������������Ƶ�CrO2-��AlO2-��Һ������������CrO2-����ΪCrO42-���ټ�����ǣ����˵���������������S2O32-��AlO2-��Һ����S2O32-��AlO2-��Һ��ͨ�������̼�����˵�����BΪAl��OH��3�������������ȷֽ��Al2O3�����Al2O3�������������������ڿ����г�ּ��ȵ�Cr2O3��Cr2O3��Al�������ȷ�Ӧ�ø����Դ˽����⣮
��� �⣺�����Թ�ҵ��Һ����H+��Al3+��Mg2+��Cr3+��SO42-���м���Al2O3��������Һ��pHֵ���õ�����AΪ����������������������Һ����Ҫ������þ��Һ������A�м���������������Ƶ�CrO2-��AlO2-��Һ������������CrO2-����ΪCrO42-���ټ�����ǣ����˵���������������S2O32-��AlO2-��Һ����S2O32-��AlO2-��Һ��ͨ�������̼�����˵�����BΪAl��OH��3�������������ȷֽ��Al2O3�����Al2O3�������������������ڿ����г�ּ��ȵ�Cr2O3��Cr2O3��Al�������ȷ�Ӧ�ø���
��1����������ķ�����֪�����Թ�ҵ��Һ�м��������������������ǵ�����Һ��pH���õ���������������������
�ʴ�Ϊ��������Һ��pH��
��2������ٵ�ʵ��Ŀ���ǵõ������������������������ݱ��е����ݿ�֪����Һ��pHӦ�����ڣ�5.3��7.8����Χ��
�ʴ�Ϊ����5.3��7.8����
��3�������������NaCrO2�����ӷ���ʽΪCr��OH��3+OH-=CrO2-+2H2O��
�ʴ�Ϊ��Cr��OH��3+OH-=CrO2-+2H2O��
��4�������������CrO42-����������ԭ��Ӧ�����������������Ӻ�������������Ӧ�����ӷ���ʽΪ7H2O+4CrO42-+6S=4Cr��OH��3��+3S2O32-+2OH-��
�ʴ�Ϊ��7H2O+4CrO42-+6S=4Cr��OH��3��+3S2O32-+2OH-��
��5����������ķ�����֪��������ڿ����г�����յ�Ŀ����ʹCr��OH��3��ȫת��ΪCr2O3��������ȿ��������м��ȣ��ʿ�ѡ�õ�װ����D��
�ʴ�Ϊ��ʹCr��OH��3��ȫת��ΪCr2O3��D��
��6�������Ϊ���ȷ�Ӧ�������Ļ�ѧ��Ӧ����ʽΪCr2O3+2Al$\frac{\underline{\;\;��\;\;}}{\;}$2Cr+Al2O3��
�ʴ�Ϊ��Cr2O3+2Al$\frac{\underline{\;\;��\;\;}}{\;}$2Cr+Al2O3��
���� �������ڹ��������Ʊ���Ŀ��Ϊ��Ƶ���㣬������ѧ���ķ���������ʵ�������Ŀ��飬�����Ʊ�ԭ����ʵ�鷽�����ۡ����ʷ����ᴿ����ȡ��Ϣ���������ǶԻ���֪ʶ���ۺϿ��飬�Ѷ��еȣ�


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ع���ʱ�������ɸ���ͨ�����·�������� | |
| B�� | ��״���£���Ӧ3.36L������ת�Ƶ���0.2mol | |
| C�� | ����ȼ�ϵ�����������ʲ���ͬ������ֱ��ȼ�յ����������� | |
| D�� | ����Ϊ����Ⱦ��ˮ�����ڻ����Ѻõ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
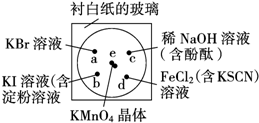 ��ѧʵ����ͻ�����Ч�ؼ�����Ⱦ��ʵ�ֻ�ѧʵ����ɫ����Ҫ��ijѧ�������в�����һ��ʵ�飺��һ���³İ�ֽ�IJ���Ƭ�IJ�ͬλ�÷ֱ�μ�Ũ��Ϊ0.1mol/L ��KBr��KI����������Һ����NaOH������̪����FeCl2����KSCN����Һ��1�Σ�ÿ��Һ�α˴˷ֿ���Χ�ɰ뾶С�ڱ������Բ�Σ���ͼ��ʾ������Բ�Ĵ�����2��֥������С��KMnO4���壬��KMnO4����μ�һ��Ũ���ᣬ��������������Ǻã�����֪��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O��
��ѧʵ����ͻ�����Ч�ؼ�����Ⱦ��ʵ�ֻ�ѧʵ����ɫ����Ҫ��ijѧ�������в�����һ��ʵ�飺��һ���³İ�ֽ�IJ���Ƭ�IJ�ͬλ�÷ֱ�μ�Ũ��Ϊ0.1mol/L ��KBr��KI����������Һ����NaOH������̪����FeCl2����KSCN����Һ��1�Σ�ÿ��Һ�α˴˷ֿ���Χ�ɰ뾶С�ڱ������Բ�Σ���ͼ��ʾ������Բ�Ĵ�����2��֥������С��KMnO4���壬��KMnO4����μ�һ��Ũ���ᣬ��������������Ǻã�����֪��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
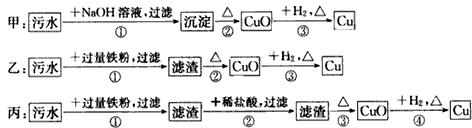
| A�� | ����ʵ�鷽���ж����Ƶô���ͭ | |
| B�� | �����еķ�Ӧ�漰�û����ֽ⡢���ֽ����ַ�Ӧ���� | |
| C�� | �ҷ����мӹ�������ֻ�ܻ�ԭ���еĶ��������� | |
| D�� | �������������������Ⱦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
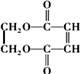 �ĺϳ�·����ͼ��
�ĺϳ�·����ͼ��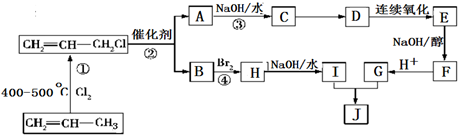
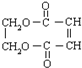 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
| T | M������2�ԳɶԵ��� |
| X | �����������Ǵ�����������2�� |
| Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯���ˮ��Һ�Լ��� |
| Z | ������Ԫ����������ϼ���+7�� |
| W | 3d�ܼ���������������������3�� |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.1 mol•L-1�Ĵ�����Һ�м�ˮ��ͨ��HCl���嶼��ʹ$\frac{c��{H}^{+}��}{c��C{H}_{3}COOH��}$ֵ���� | |
| B�� | 0.1 mol•L-1�Ĵ�������Һ20 mL��0.1 mol•L-1����10 mL��Ϻ���Һ�����ԣ�����c��CH3COO-����c��Cl-����c��H+����c��CH3COOH�� | |
| C�� | �����ʵ���Ũ�ȵ������NH4HSO4��NaOH��Һ��ϣ�c ��Na+���Tc ��SO42-����c��NH4+����c��H+����c��OH-�� | |
| D�� | 0.1 mol•L-1ijһԪ��HA��Һ��$\frac{c��O{H}^{-}��}{c��{H}^{+}��}$=1��10-8�������Һ����ˮ�������c��H+��=1��10-11mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | [Cl-]��[NH4+]��[H+]��[OH-] | B�� | [Cl-]��[H+]��[NH4+]��[OH-] | C�� | [NH4+]��[OH-]��[Cl-]��[H+] | D�� | [OH-]��[H+]��[Cl-]��[NH4+] |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com