
 在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.
在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.分析 (1)根据热化学方程式和盖斯定律计算得到,反应焓变与反应过程无关;
(2)在25℃、101kPa下,16g甲醇燃烧生成CO2和液态水时放热363.26kJ,32g甲醇燃烧生成液态水和二氧化碳气体放热363.26kJ×2=726.52kJ,依据热化学方程式的书写方法和注意问题,标注对应反应的焓变写出;
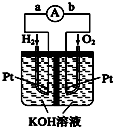
(3)①原电池是将化学能转变为电能的装置,原电池放电时,电子从负极沿导线流向正极;
②负极上燃料失电子发生还原反应.
解答 解:(1)①C(s)+O2(g)═CO2(g)△H1=-437.3kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-285.8kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律①-②-③,得到:C(s)+H2O(g)═CO(g)+H2(g)△H=-437.3-(-285.8)-(-283.0)=+131.5kJ•mol-1,
故答案为:+131.5kJ•mol-1;
(2)在25℃、101kPa下,16g甲醇燃烧生成CO2和液态水时放热363.26kJ,32g甲醇燃烧生成液态水和二氧化碳气体放热363.26kJ×32=726.52KJ,反应的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.52kJ/mol;
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.52kJ/mol;
(3)①该装置是把化学物质中的能力转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是 由a流向b,
故答案为:化学能转变为电能;a流向;
②碱性环境中,该反应中负极上氢气失电子生成氢离子,电极反应式为H2+2OH--2e-═2H2O,
故答案为:2H2+4OH--4e-═4H2O.
点评 本题考查热化学方程式书写、盖斯定律的计算应用、原电池原理的应用等,侧重于反应原理的应用的考查,题目难度中等,注意盖斯定律的含义及应用方法.


科目:高中化学 来源: 题型:解答题
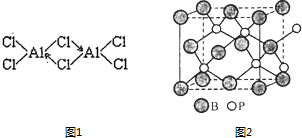 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: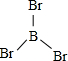 三溴化磷
三溴化磷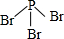
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,OH-向负极方向移动 | |
| B. | 放电时,正极反应式为Zn+2OH--2e-═ZnO+H2O | |
| C. | 充电时,Zn发生氧化反应 | |
| D. | 充电时,阴极附近PH 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
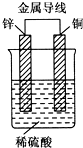 锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
| A. | ①②③ | B. | ③④⑤ | C. | ①⑤⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
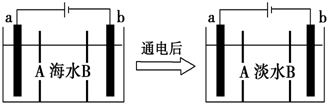
| A. | A膜是阳离子交换膜(只允许阳离子通过) | |
| B. | 通电后,海水中阴离子往b电极处运动 | |
| C. | 通电后,a电极的电极反应为4OH-4e-═O2↑+2H2O | |
| D. | 通电后,b电极上产生无色气体,溶液中出现少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,①不能(填“能”或“不能”)确定产物中铁元素的价态 |
| 步骤2: 取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫红色褪去或变浅,说明产物中含+2价铁元素,若KMnO4溶液不褪色或红色不变浅,说明产物中不含+2价铁元素 |
| 步骤3:③另取少量溶液,滴加KSCN溶液 | 若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NO | N2 | CO2 | |
| 起始浓度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.04 | 0.03 | 0.03 |
 ,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).
,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com