

| A£® | Ņ»¶Øŗ¬ÓŠAl£¬ĘäÖŹĮæĪŖ2.7g | |
| B£® | Ņ»¶Øŗ¬ÓŠ£ØNH4£©2SO4ŗĶMgCl2£¬ĒŅĪļÖŹµÄĮæĻąµČ | |
| C£® | Ņ»¶Øŗ¬ÓŠMgCl2ŗĶFeCl2 | |
| D£® | Ņ»¶Ø²»ŗ¬FeCl2£¬æÉÄÜŗ¬ÓŠMgCl2ŗĶAlCl3 |
·ÖĪö 14.05g¹ĢĢå¼ÓČė¹żĮæµÄÅØĒāŃõ»ÆÄĘČÜŅŗ£¬²śÉśĘųĢå5.60L£¬ļ§ŃĪ”¢Al¾łÓėNaOHČÜŅŗÉś³ÉĘųĢ壬5.60LĘųĢåĶعż¼īŹÆ»ŅĪŽ±ä»Æ£¬ĖµĆ÷ĘųĢåÖŠĪŽÓė¼īŹÆ»Ņ·“Ó¦µÄĘųĢ壬ĪŽĖ®ÕōĘųµÄ“ęŌŚ£¬ĶعżÅØĮņĖį£¬ĘųĢåŹ£Óą3.36L£¬Ģå»ż¼õÉŁ5.60L-3.36L=2.24L£¬Ōņ5.6LĘųĢåÖŠ°±ĘųĪŖ2.24L£¬ĒāĘųĪŖ3.36L£¬»ģŗĻĪļÖŠŗ¬ÓŠĮņĖįļ§”¢Al£»
²śÉśµÄ°×É«³Įµķ2.9g£¬¾ĆÖĆĪŽ±ä»Æ£¬Ōņ»ģŗĻĪļŅ»¶Ø²»“ęŌŚFeCl2£¬ÓÉÓŚĒāŃõ»ÆĀĮČÜÓŚĒæ¼ī£¬ĖłŅŌÄÜÉś³É°×É«³ĮµķŅ»¶ØĪŖĒāŃõ»ÆĆ¾£¬»ģŗĻĪļÖŠŅ»¶Øŗ¬ÓŠMgCl2£»
µĆµ½ĪŽÉ«ČÜŅŗ£¬¼ÓČėŹŹĮæŃĪĖį»įÉś³É³Įµķ£¬ĖµĆ÷½šŹōĀĮ»ņĀČ»ÆĀĮÓė¹żĮæ¼ī·“Ӧɜ³ÉµÄĘ«ĀĮĖįÄĘÓėŃĪĖį·“Ӧɜ³ÉµÄĒāŃõ»ÆĀĮ³Įµķ£¬¼ÓČė¹żĮæŃĪĖį³ĮµķČܽā½ųŅ»²½Ö¤Ć÷³ĮµķŹĒĒāŃõ»ÆĀĮ£®
½ā“š ½ā£ŗ14.05g¹ĢĢå¼ÓČė¹żĮæµÄÅØĒāŃõ»ÆÄĘČÜŅŗ£¬²śÉśĘųĢå5.60L£¬ļ§ŃĪ”¢Al¾łÓėNaOHČÜŅŗÉś³ÉĘųĢ壬5.60LĘųĢåĶعż¼īŹÆ»ŅĪŽ±ä»Æ£¬ĖµĆ÷ĘųĢåÖŠĪŽÓė¼īŹÆ»Ņ·“Ó¦µÄĘųĢ壬ĪŽĖ®ÕōĘųµÄ“ęŌŚ£¬ĶعżÅØĮņĖį£¬ĘųĢåŹ£Óą3.36L£¬Ģå»ż¼õÉŁ5.60L-3.36L=2.24L£¬Ōņ5.6LĘųĢåÖŠ°±ĘųĪŖ2.24L£¬ĒāĘųĪŖ3.36L£¬»ģŗĻĪļÖŠŗ¬ÓŠĮņĖįļ§”¢Al£»
²śÉśµÄ°×É«³Įµķ2.9g£¬¾ĆÖĆĪŽ±ä»Æ£¬Ōņ»ģŗĻĪļŅ»¶Ø²»“ęŌŚFeCl2£¬ÓÉÓŚĒāŃõ»ÆĀĮČÜÓŚĒæ¼ī£¬ĖłŅŌÄÜÉś³É°×É«³ĮµķŅ»¶ØĪŖĒāŃõ»ÆĆ¾£¬»ģŗĻĪļÖŠŅ»¶Øŗ¬ÓŠMgCl2£»
µĆµ½ĪŽÉ«ČÜŅŗ£¬¼ÓČėŹŹĮæŃĪĖį»įÉś³É³Įµķ£¬ĖµĆ÷½šŹōĀĮ»ņĀČ»ÆĀĮÓė¹żĮæ¼ī·“Ӧɜ³ÉµÄĘ«ĀĮĖįÄĘÓėŃĪĖį·“Ӧɜ³ÉµÄĒāŃõ»ÆĀĮ³Įµķ£¬¼ÓČė¹żĮæŃĪĖį³ĮµķČܽā½ųŅ»²½Ö¤Ć÷³ĮµķŹĒĒāŃõ»ÆĀĮ£®
A£®¹ĢĢå»ģŗĻĪļÖŠŅ»¶Øŗ¬ÓŠAl£¬Al·“Ӧɜ³É±źæöĻĀ3.36LĒāĘų£¬ĒāĘųĪŖ$\frac{3.36L}{22.4L/mol}$=0.15mol£¬øł¾Żµē×Ó×ŖŅĘŹŲŗćæÉÖŖAlµÄĪļÖŹµÄĮæĪŖ$\frac{0.15mol”Į2}{3}$=0.1mol£¬ŌņAlµÄÖŹĮæĪŖ0.1mol”Į27g/mol=2.7g£¬¹ŹA“ķĪó£»
B£®Ō¹ĢĢå»ģŗĻĪļÖŠŅ»¶Øŗ¬ÓŠ£ØNH4£©2SO4”¢MgCl2£¬ĮņĖįļ§µÄĪļÖŹµÄĮæĪŖ£ŗ$\frac{2.24L}{22.4L/mol}$”Į$\frac{1}{2}$=0.05mol£¬ĀČ»ÆĆ¾µÄĪļÖŹµÄĮæĪŖ£ŗ$\frac{2.9g}{58g/mol}$=0.05mol£¬ĖłŅŌ¶žÕßµÄĪļÖŹµÄĮæĻąµČ£¬¹ŹBÕżČ·£»
C£®øł¾Ż¼ÓČėĒāŃõ»ÆÄĘČÜŅŗŗóÉś³É°×É«³Įµķ£¬ĒŅ°×É«³Įµķƻӊ±ä»Æ£¬Ōņ¹ĢĢå»ģŗĻĪļÖŠŅ»¶Øŗ¬ÓŠMgCl2£¬Ņ»¶Ø²»ŗ¬FeCl2£¬¹ŹC“ķĪó£»
D£®øł¾ŻŅŌÉĻ·ÖĪöæÉÖŖ£¬¹ĢĢå»ģŗĻĪļÖŠŅ»¶Øŗ¬ÓŠMgCl2£¬æÉŅŌ¼ĘĖćAl”¢ĮņĖįļ§”¢ĀČ»ÆĆ¾µÄÖŹĮ棬½įŗĻ×ÜÖŹĮæÅŠ¶ĻŹĒ·ńŗ¬ÓŠĀČ»ÆĀĮ£¬¹ŹD“ķĪó£®
¹ŹŃ”B£®
µćĘĄ ±¾Ģā×ŪŗĻæ¼²éĪļÖŹ×é³ÉµÄ²ā¶Ø”¢»ģŗĻĪļµÄ¼ĘĖć£¬¹Ų¼üŹĒøł¾ŻĻÖĻóÓėŹż¾ŻÅŠ¶Ļŗ¬ÓŠµÄĪļÖŹ£¬²ąÖŲæ¼²éѧɜ·ÖĪö¼ĘĖćÄÜĮ¦”¢ŌŖĖŲ»ģŗĻĪļŠŌÖŹµČ£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
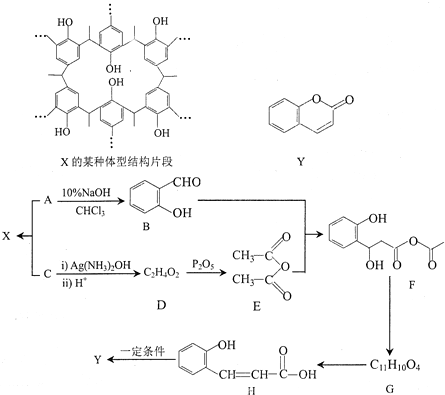
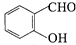 ÖŠµÄ¹ŁÄÜĶÅĆū³ĘĪŖČ©»ł”¢ōĒ»ł
ÖŠµÄ¹ŁÄÜĶÅĆū³ĘĪŖČ©»ł”¢ōĒ»ł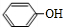 £¬DCH3COOH£¬G
£¬DCH3COOH£¬G

 £©µŖŌ×ÓÉĻµÄĒāŌ×ÓæÉŅŌĻńAÉĻµÄĒāŌ×ÓŅ»ŃłÓėC·¢Éś¼Ó³É·“Ó¦£¬ŌŁĖõ¾Ū³Éøß·Ö×Ó»ÆŗĻĪļ£®Š“³öÄņĖŲÓėCŌŚŅ»¶ØĢõ¼žĻĀÉś³ÉĻߊŌøß·Ö×Ó»ÆŗĻĪļµÄ»Æѧ·½³ĢŹ½
£©µŖŌ×ÓÉĻµÄĒāŌ×ÓæÉŅŌĻńAÉĻµÄĒāŌ×ÓŅ»ŃłÓėC·¢Éś¼Ó³É·“Ó¦£¬ŌŁĖõ¾Ū³Éøß·Ö×Ó»ÆŗĻĪļ£®Š“³öÄņĖŲÓėCŌŚŅ»¶ØĢõ¼žĻĀÉś³ÉĻߊŌøß·Ö×Ó»ÆŗĻĪļµÄ»Æѧ·½³ĢŹ½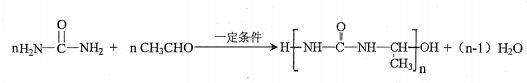
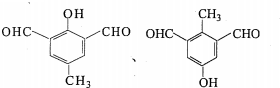 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na2CO3ÓėAl£ØOH£©3¶¼Äܹ»×÷ĪŖÖĪĮĘĪøĖį¹ż¶ąµÄŅ©Ę· | |
| B£® | æÉŅŌÓĆĀĮÖĘĘ÷ĆóŹ¢·ÅÅØĮņĖįŗĶÅØĒāŃõ»ÆÄĘČÜŅŗ | |
| C£® | Ņ½ŌŗĄļÓĆøßĆĢĖį¼ŲČÜŅŗŗĶĖ«ŃõĖ®Ą“Ļū¶¾£¬ŹĒŅņĪŖĮ½ÕßӊijÖÖ¹²Ķ¬µÄŠŌÖŹ | |
| D£® | ŌŚĖ®ÖŠĶ¶ČėŹŹĮæµÄĒāŃõ»ÆÄĘ¹ĢĢåæÉŅŌŌö“óĆ÷·ÆµÄ¾»Ė®Š§¹ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  | B£® |  | C£® |  | D£® | H2S |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ķ¬Ņ»Ö÷×åĻąĮŚĮ½øöÖÜĘŚµÄŌŖĖŲµÄŌ×ÓŠņŹż²īĪŖÉĻŅ»ÖÜĘŚĖłŗ¬ŌŖĖŲÖÖĄą | |
| B£® | ¶ĢÖÜĘŚŌŖĖŲÖŠĶ¬Ö÷×åŌŖĖŲXµÄŌ×ÓŠņŹż²»æÉÄÜŹĒYµÄ2±¶ | |
| C£® | L²ćÉĻµÄµē×ÓŹżĪŖĘꏿµÄŌŖĖŲŅ»¶ØŹĒÖ÷×åŌŖĖŲ | |
| D£® | ÄæĒ°Ź¹ÓƵÄŌŖĖŲÖÜĘŚ±ķÖŠ£¬×ī³¤µÄÖÜĘŚŗ¬36ÖÖŌŖĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 £Ø1£©ÅäÖĘ0.5mol/LµÄNaOHČÜŅŗ£¬¶ØČŻŹ±ĻņČŻĮæĘæÖŠ¼ÓÕōĮóĖ®³¬¹żæĢ¶ČĻߣ¬Ęä½į¹ūĘ«Š”£®£ØĢī”°Ę«“ó”±”¢”°Ę«Š””±”¢»ņ”°²»±ä”±£©
£Ø1£©ÅäÖĘ0.5mol/LµÄNaOHČÜŅŗ£¬¶ØČŻŹ±ĻņČŻĮæĘæÖŠ¼ÓÕōĮóĖ®³¬¹żæĢ¶ČĻߣ¬Ęä½į¹ūĘ«Š”£®£ØĢī”°Ę«“ó”±”¢”°Ę«Š””±”¢»ņ”°²»±ä”±£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŃĒĮņõ£ĀČ£ØSOCl2£©ŹĒŅ»ÖÖŅŗĢ¬µÄ¹²¼Ū»ÆŗĻĪļ£¬·Šµć78.8”ę£¬ČŪµć-105”ę
ŃĒĮņõ£ĀČ£ØSOCl2£©ŹĒŅ»ÖÖŅŗĢ¬µÄ¹²¼Ū»ÆŗĻĪļ£¬·Šµć78.8”ę£¬ČŪµć-105”ę²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com