
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2p轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为 形;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B C(填“大于”或“小于”);A、C两元素可组成原子个数比为1∶1 的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为 ;F单质形成的晶体类型为 。
(4)F元素氧化物的熔点比其硫化物的 (填“高”或“低”),请解释其原因
。
(5)E元素与C元素形成的化合物是 化合物,其晶体熔化时破坏的作用力是 ,晶体EC的熔点比晶体BC2的熔点 (填“高”或“低”)。
(1)直线 1s22s22p63s23p63d9或[Ar]3d9
(2)小于 sp3
(3)分子晶体 金属晶体
(4)高 CuO的晶格能大于CuS的晶格能
(5)离子 离子键 高
【解析】由题意可以判断出A为H元素,根据电子排布特点可以得出B为C元素,C为O元素。电负性最大的是非金属性最强的F元素,E为Ca元素,F应该是29号元素Cu。(1)CO2的空间构型为直线形,Cu2+电子排布式为1s22s22p63s23p63d9或[Ar]3d9。(2)氧元素非金属性比碳元素强,可知稳定性CH4<H2O,H2O2的O的杂化类型,根据VSEPR模型应该是四面体形,sp3杂化。(3)冰为分子晶体,Cu为金属晶体。(4)离子晶体 半径小于
半径小于 半径,故CuO的离子键强,晶格能较大,熔点较高。(5)CaO是离子化合物,晶体熔化时破坏离子键,CO2形成的晶体为分子晶体,熔点较低。
半径,故CuO的离子键强,晶格能较大,熔点较高。(5)CaO是离子化合物,晶体熔化时破坏离子键,CO2形成的晶体为分子晶体,熔点较低。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考化学名师选择题专练 有机物组成练习卷(解析版) 题型:选择题
已知丁基有四种同分异构体,戊基有八种同分异构体。某组成为C5H12O的醇可被氧化成为C5H10O的醛,具有这种结构的醇的同分异构体共有( )
A.2种 B.4种 C.8种 D.14种
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( )
A.推广使用风能、太阳能等新能源能够减少温室气体的排放
B.餐桌上的瓷盘是硅酸盐制品
C.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
D.用“84”消毒液来杀死H1N1流感病毒是因为病毒蛋白质变性
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,若等质量的H2O和D2O分别与一定质量的金属钾完全反应,转移的电子数均为 NA,则下列各量不相等的是( )
NA,则下列各量不相等的是( )
A.消耗H2O和D2O的物质的量
B.同温同压下生成气体的体积
C.反应后所得溶液中溶质的质量分数
D.参加反应的钾的质量
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质结构与性质练习卷(解析版) 题型:填空题
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
X | 578 | 1 817 | 2 745 | 11 578 |
Y | 738 | 1 451 | 7 733 | 10 540 |
Z | 496 | 4 562 | 6 912 | 9 543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能的原因是
。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C三原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示)。
②M是含有 键的 分子(填“极性”或“非极性”)。
③N是一种易液化的气体,请简述其易液化的原因:
。
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 。
⑤AB-中和B2分子的π键数目比为 。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①E元素组成的单质的晶体堆积模型为 (填字母)。
a.简单立方堆积b.体心立方堆积
c.六方最密堆积d.面心立方最密堆积
②F元素在其化合物中最高化合价为 。
③G2+的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。
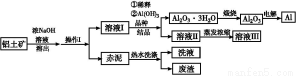
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 有机合成与推断练习卷(解析版) 题型:填空题
已知:Ⅲ能与NaHCO3溶液反应,Ⅲ和Ⅳ的相对分子质量相等且Ⅳ催化氧化的产物不能发生银镜反应。
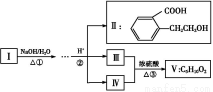
(1)化合物Ⅲ中官能团的名称是 ;Ⅱ不能发生的反应是 。
A.加成反应B.消去反应
C.酯化反应D.水解反应
(2)反应③的类型为 。
(3)Ⅴ的结构简式为 ,Ⅰ的结构简式为 。
(4)化合物Ⅵ是Ⅱ的同分异构体,同时符合下列四种条件,则Ⅵ的结构简式为 。
A.苯环上有两个取代基且苯环上的一氯代物有2种
B.能与FeCl3溶液发生显色反应
C.能发生水解反应
D.核磁共振氢谱有6个峰,峰的面积之比为1∶2∶2∶2∶2∶1
(5)化合物Ⅱ发生分子内成环反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:填空题
元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为 。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示)
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似金刚石,甚至硬度超过金刚石,其原因是
(6)如图为石墨晶胞结构示意图,该晶胞中含有碳原子的个数为
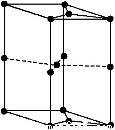
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题8化学反应速率与化学平衡练习卷(解析版) 题型:填空题
水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH=+131 kJ·mol-1
CO (g)+H2 (g) ΔH=+131 kJ·mol-1
(1)T温度下,四个容器中均进行着上述反应,各容器中碳足量,其他物质的物质的量浓度及正、逆反应速率关系如下表所示。请填写表中相应的空格。
容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
Ⅰ | 0.06 | 0.60 | 0.10 | v正=v逆 |
Ⅱ | 0.06 | 0.50 | 0.40 | ① |
Ⅲ | 0.12 | 0.40 | 0.80 | v正<v逆 |
Ⅳ | 0.12 | 0.30 | ② | v正=v逆 |
① ,② 。
在T温度下该反应的化学平衡常数为 。
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0 mol碳和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 碳,水蒸气的转化率将 (填 “增大”、“减小”或“不变”)。
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)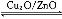 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。
CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com