
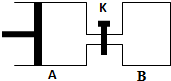
 如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:
如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:分析 (1)A为恒温恒压,利用体积之比等于物质的量之比求出平衡时A中混合气体的物质的量,由方程式可知1molX反应时混合气体物质的量增大1mol,即消耗的X的物质的量等于混合气体物质的量增大量,进而计算X的转化率;
(2)A为恒温恒压,B为恒温恒容,随反应进行B中压强增大,故平衡时A中容器压强小于B中压强,B可以等效为在A的基础上增大压强,平衡逆向移动;
(3)打开开关K,保持温度不变,再达平衡时,等效为开始加入3molX、3molY到达的平衡,恒温恒压下与A中平衡为等效平衡,反应物转化率不变,平衡时混合气体总物质的量为A中3倍,恒温恒压下压强之比等于物质的量之比,进而计算开始加入3molX、3molY到达的平衡时总体积,减去容器B的体积即为A容器体积.
解答 解:(1)A为恒温恒压,反应达到平衡时,A的体积为1.2aL,则平衡时混合气体总物质的量为(1+1)mol×$\frac{1.2aL}{aL}$=2.4mol,由方程式可知1molX反应时混合气体物质的量增大1mol,则消耗的X的物质的量为(2.4-2)mol=0.4mol,故X的转化率为$\frac{0.4mol}{1mol}$×100%=40%,
故答案为:40%;
(2)A为恒温恒压,B为恒温恒容,随反应进行B中压强增大,故平衡时A中容器压强小于B中压强,B可以等效为在A的基础上增大压强,平衡逆向移动,B中X的转化率小于A中X的转化率,即a(A)>a(B),
故答案为:>;
(3)打开开关K,保持温度不变,再达平衡时,等效为开始加入3molX、3molY到达的平衡,恒温恒压下与A中平衡为等效平衡,反应物转化率不变,平衡时混合气体总物质的量为A中3倍,恒温恒压下压强之比等于物质的量之比,则开始加入3molX、3molY到达的平衡时总体积为1.2aL×3=3.6aL,故B容器体积为3.6aL-aL=2.6aL,
故答案为:2.6a.
点评 本题考查化学平衡计算,涉及等效平衡问题,较好的考查学生分析解决问题能力,关键是等效平衡途径的建立,难度中等.


科目:高中化学 来源: 题型:解答题
 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
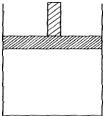 150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.
150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④ | C. | ①③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Fe3+、SO42-、Cl- | |
| B. | 饱和氯水中:K+、Na+、Cl-、HSO3- | |
| C. | 室温下,pH=13的溶液中:Na+、K+、SiO32-、Cl- | |
| D. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com