
| A. | 0.64g | B. | 1.28g | C. | 2.56g | D. | 5.12g |
分析 以惰性电极足量电解CuSO4溶液,在阳极上氢氧根离子放电生成氧气物质的量为0.02mol,阴极上铜离子得到电子析出金属铜,阳极电极反应:4OH--4e-=2H2O+O2↑,阴极电极反应:Cu2++2e-=Cu,以此来解答.
解答 解:以惰性电极足量电解CuSO4溶液,由阳极反应4OH--4e-=2H2O+O2↑可知,生成0.02mol气体时转移0.08mol电子,由电子守恒可知,阴极上Cu2++2e-=Cu,则生成Cu为$\frac{0.08mol}{2}$×64g/mol=2.56g,
点评 本题考查电解原理及计算,为高频考点,把握发生的电极反应、电解原理为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.23 g | B. | 0.46 g | C. | 0.69 g | D. | 0.92 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
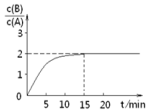 在T℃时,将一定量A加入到体积为2L的某密闭容器中,发生以下化学反应:2A(g)?B(g)+C(g)△H=-akJ/mol.反应在第15min时达到平衡,反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=0.8mol/L,下列结论正确的是( )
在T℃时,将一定量A加入到体积为2L的某密闭容器中,发生以下化学反应:2A(g)?B(g)+C(g)△H=-akJ/mol.反应在第15min时达到平衡,反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=0.8mol/L,下列结论正确的是( )| A. | 反应达平衡时,A的转化率为80% | |
| B. | A的初始物质的量为2mol | |
| C. | 反应到达平衡时,放出的热量是2a KJ | |
| D. | 15min时,v正=v逆=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 L 0.1 mol/L的NH4NO3溶液中氢原子总数为0.4NA | |
| B. | 0.5 mol 甲基中电子数为5NA | |
| C. | 在反应3Br2+3CO32-=5Br-+BrO3-+3CO2↑中,每生成3 mol CO2转移的电子数为5NA | |
| D. | 常温常压下,22.4 L N2H4中N-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
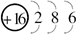 ;化合物BA4的电子式为
;化合物BA4的电子式为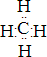 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com