
【题目】已知![]() 表示阿伏加德罗常数的值,下列有关说法正确的是( )
表示阿伏加德罗常数的值,下列有关说法正确的是( )
A.1 mol CnH2n(n≥2)中所含的共用电子对数为(3n+1)NA
B.在12.0 g NaHSO4 和MgSO4混合物中,所含离子数目为0.2NA
C.1 L 1 mol·L-1饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶粒数为NA
D.标准状况下8.96 L D2含有中子数0.4NA
【答案】B
【解析】
A.CnH2n中C原子与H原子之间的共用电子对为2n对,而C原子之间的共用电子对为n-1+1=n对,即CnH2n中含共用电子对为2n+n=3n对,故1 mol CnH2n(n≥2)中所含的共用电子对数为3nNA,故A错误;
B.硫酸氢钠和硫酸镁的摩尔质量相等都是120g/mol,12gNaHSO4和MgSO4的混合物,物质的量为0.1mol,由于NaHSO4中仅含有Na+和HSO4-,MgSO4中含有Mg2+和SO42-,则1mol各物质,均只含2mol离子,因而0.1mol该混合物中,所含离子数目为0.2NA,故B正确;
C.由于氢氧化铁胶体的胶粒是氢氧化铁的集合体,无法计算,胶粒数应小于NA,故C错误;
D.标准状况下8.96 L D2为![]() =0.4mol,而一个D原子中有一个中子,一个D2中有2个中子,0.4molD2中有0.8NA,故D错误。
=0.4mol,而一个D原子中有一个中子,一个D2中有2个中子,0.4molD2中有0.8NA,故D错误。
答案为B。


科目:高中化学 来源: 题型:
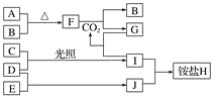
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。
请回答下列问题:
(1)E和J的化学式分别是________和________。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________。
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
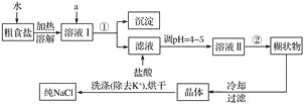
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL 二氧化碳气体(在标准状况下)。求原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是多少?________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
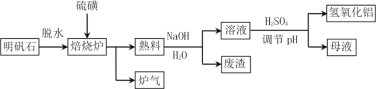
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用苯乙酮间接电氧化法合成苯甲酸,原理如图所示:

实验步骤如下:
步骤I:电合成:在电解池中加入KI、20mL蒸馏水和20mL的1,4-二氧六环,搅拌至完全溶解,再加入20mL苯乙酮,连接电化学装置,恒定电压下电解7h;
步骤II:清洗分离:反应停止后,将反应液转移至烧瓶,蒸馏除去反应溶剂;用蒸馏水和二氯甲烷洗涤烧瓶,将洗涤液转移至分液漏斗;用二氯甲烷萃取除去质,分离出水相和有机相;
步骤III:制得产品:用浓盐酸酸化水相至pH为1~2,接着加入饱和NaHSO3溶液,振荡、抽滤、干燥,称量得到产品7.8g;
有关物质的数据如下表所示:
物质 | 分子式 | 溶解性 | 沸点(℃) | 密度(g/cm3) | 相对分子质量 |
苯乙酮 | C8H8O | 难溶于水 | 202.3 | 1.03 | 120 |
苯甲酸 | C7H6O2 | 微溶于水 | 249 | 1.27 | 122 |
二氯甲烷 | CH2Cl2 | 不溶于水 | 40 | 1.33 | 85 |
回答下列问题:
(1)步骤I中,阴极的电极反应式为________________________ ,苯乙酮被氧化的离子方程式为_____________________
(2)步骤II蒸馏过程中,需要使用到的玻璃仪器有____________,(填标号)除此之外还需要____________________
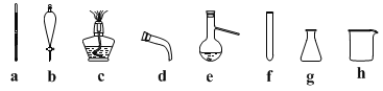
(3)步骤II分液过程中,应充分振荡,静置分层后________(填标号)
A.直接将有机相从分液漏斗的上口倒出
B.直接将有机相从分液漏斗的下口放出
C.先将有机相从分液漏斗的下口放出,再将水相从下口放出
D.先将有机相从分液漏斗的下口放出,再将水相从上口倒出
(4)步骤III中,加入浓盐酸的目的是____________________
(5)步骤III中,加入饱和NaHSO3溶液,水相中的颜色明显变浅,说明过量的I2被还原为I-,其离子方程式为_______________________
(6)本实验的产率是______________(保留小数后一位有效数字)
(7)得到的粗苯甲酸可用____________法进行提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿茶中含有的一种物质EGCG具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的一种衍生物A的结构如图所示。有关衍生物A说法错误的是
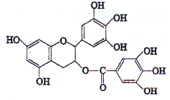
A.A能与碳酸氢钠溶液反应放出二氧化碳
B.A在空气中易氧化,遇FeCl3溶液能发生显色反应
C.1molA与足量的浓溴水反应最多可与6 mol Br2作用
D.1 molA最多可与含10mol氢氧化钠的溶液完全作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com