
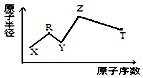
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | Y的单质易与R、T的氢化物反应 | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
分析 现有短周期主族元素X、Y、Z、R、T.结合五种元素的原子半径与原子序数的关系图可知,Z的原子半径最大,X的原子半径和原子序数均最小,X为H元素;由R原子最外层电子数是电子层数的2倍,R为第二周期的C元素;Y与Z能形成Z2Y、Z2Y2型离子化合物,则Z为Na元素,Y为O元素,Z与T形成的Z2T 化合物能破坏水的电离平衡,T为S元素,以此来解答.
解答 解:由上述分析可知,X为H,R为C,Y为O,Z为Na,T为S,
A.电子层越多,原子半径越大,则原子半径为Y<Z,而具有相同电子排布的离子中原子序数大的离子半径小,则离子半径为Y>Z,故A错误;
B.Y的单质为氧气,与R的氢化物发生燃烧反应,与T的氢化物反应生成S和水,故B正确;
C.非金属性S>C,则最高价氧化物对应的水化物的酸性:T>R,故C错误;
D.由H、C、O、Na四种元素组成的化合物不仅仅为NaHCO3,可能为有机盐且含有羧基,溶液不一定为碱性,可能为酸性,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、原子序数、元素化合物知识来推断元素为解答的关键,侧重分析与推断能力的考查,注意规律性知识的应用,选项D为解答的易错点,题目难度不大.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:C<O<N | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
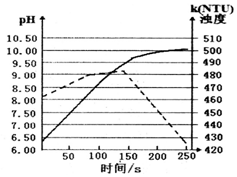 将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )
将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )| A. | 该实验是在常温下进行的 | |
| B. | 实线表示溶液浊度随时间的变化 | |
| C. | 50s时向溶液中滴入酚酞试液,溶液变红 | |
| D. | 150s后溶液浊度下降是因为生成的Mg(OH)2沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离常数K(NH3•H2O)>K(HCN) | |
| B. | 室温时,相同体积、相同pH的盐酸和醋酸溶液中由水电离出的c(H+):盐酸小于醋酸溶液 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO2-4且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO2-4先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
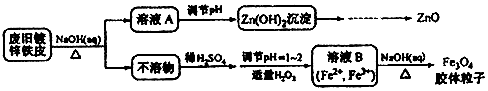
| A. | 用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层 | |
| B. | 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnO | |
| C. | 由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化 | |
| D. | Fe3O4胶体粒子能用减压过滤法实现固液分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镁是一种重要的金属资源,在各领域都具有重要的作用.
镁是一种重要的金属资源,在各领域都具有重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2$\stackrel{O_{2}/高温}{→}$SO2$\stackrel{H_{2}O_{2}(aq)}{→}$H2SO4 | |
| B. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| C. | MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)$\stackrel{电解}{→}$Mg | |
| D. | 1mol•L-1HCl(aq)$\stackrel{MnO_{2}/△}{→}$Cl2$\stackrel{石灰乳}{→}$Ca(ClO)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH有酸性,而醇、酮类物质没有酸性 | |
| B. | 甲苯使酸性高锰酸钾褪色,而苯不能使其褪色 | |
| C. | 苯酚遇铁离子发生显色反应,而醇不能 | |
| D. | 乙醛与HCN发生加成反应,乙烯不能与之加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com