
已知在密闭容器中发生的反应:H2(g)+ I2(g) 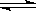 2 HI(g) △H<0 。若改变下列条件,则其反应速率发生的变化是(在表格的相应空格内填“√”)
2 HI(g) △H<0 。若改变下列条件,则其反应速率发生的变化是(在表格的相应空格内填“√”)
| 序号 | 改变条件 | 反应速率变化 | ||
| 增大 | 减小 | 不变 | ||
| (1) | 升高温度 | |||
| (2) | 充入更多的H2 | |||
| (3) | 扩大容器的体积 | |||
| (4) | 定容充入氦气 |
科目:高中化学 来源: 题型:
按要求填空:
(1)(9分)写出下列反应的化学方程式:
①实验室制取氨气 ___________________________________________
②浓硝酸的见光分解_______________________________________
③二氧化氮和水反应_______________________
(2)(10分)A、B、C、D为中学常见物质且均含有同一种元素,相互转化关系如图(反应条件及其他物质已经略去):
A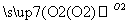 B
B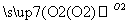 C
C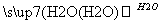 D
D
①若A、B、C、D均为含硫化合物,其中的B具有漂白性,而且它们的水溶液均能使湿润的蓝色石蕊试纸变红,则D为(填写化学式):______。写出B→C的化学方程式:_____________。
②若A是氢化物,其水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则D的化学式为______。写出A→B的化学方程式: ________________。
③若A为金属单质,组成元素的原子所含质子的数目小于18,D为强碱,写出C→D的化学方程式:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下的可逆反应:2SO2(g)+O2(g)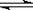 2SO3(g),若改变下列条件:①升高温度
2SO3(g),若改变下列条件:①升高温度
②增大压强 ③增大反应物浓度 ④加入催化剂,可提高反应物中的活化分子百分数的是
A.① ④ B.① ③ C. ② ③ D.①
查看答案和解析>>
科目:高中化学 来源: 题型:
航天飞机用高氯酸铵(NH4ClO4)与铝粉的混合物做固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其反应的热化学方程式为:
2NH4ClO4(s)  N2(g)+4H2O(g)+Cl2(g)+2O2(g) H=Q kJ/mol
N2(g)+4H2O(g)+Cl2(g)+2O2(g) H=Q kJ/mol
下列有关上述反应的叙述中,不正确的是
A.属于分解反应
B.瞬间产生大量高温气体推动航天飞机飞行
C.能量变化主要是化学能转化为热能和动能
D.反应中高氯酸铵只起氧化剂作用
查看答案和解析>>
科目:高中化学 来源: 题型:
向某一容积为5 L的密闭容器中,加入 0.2 mol CO和0.2 mol H2O,在800℃和催化剂存在的条件下,发生如下反应:CO(g)+H2O(g) 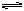 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化关系如下图所示:
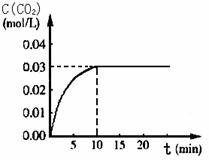
(1)由图中数据可知,反应从开始至达到平衡时,CO的化学反应速率v(CO)= ; H2的物质的量浓度c(H2)=_____________;该温度下此反应的平衡常数K = 。
(2)判断该反应是否达到平衡状态的依据是________________(填序号)。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为0
(3)若开始时向该容器中加入CO、H2O(g)、CO2和H2各0.1 mol,在相同条件下,反应达到平衡时,水蒸气的物质的量浓度c(H2O)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A | B | C | D | |
| 实验 | 用CCl4 提取溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 |
| 装置或仪器 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
日常所用干电池的电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2氧化吸收H2),电极反应可简化为:Zn-2e-=Zn2+;2NH4++2 e-=2NH3+H2(NH3再用于结合Zn2+)。根据上述叙述判断下列说法中正确的是( )
A.干电池中Zn为正极,碳为负极
B.干电池工作时,电流由Zn极经外电路流向碳极
C.干电池长时间连续使用时内装糊状物可能流出腐蚀电器
D.干电池可以实现化学能向电能的转化和电能向化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的稳定性为H2T<H2R B.单质与稀盐酸反应的剧烈程度为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com