
 TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
分析 (1)Ti的原子序数为22,比Ca的原子序数多2,以此判断;
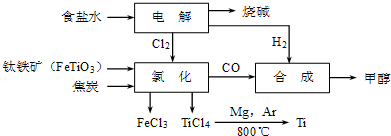
(2)钛铁矿在高温下与焦炭、氯气反应得到四氯化钛,同时生成氯化铁和CO;
(3)TiCl4水解生成TiO2•xH2O,再经焙烧制得TiO2,水解为吸热反应,从平衡移动角度分析;
(4)在Ar气中进行防止钛、镁被氧化;控制温度使TiCl4、Mg、MgCl2转化为蒸气,Ti不融化;
(5)根据甲醇的物质的量计算需要CO、H2的物质的量,根据n(CO)计算电解中生成的n(Cl2),进而计算电解生成n(H2),据此计算解答.
解答 解:(1)Ti的原子序数为22,比Ca的原子序数多2,应位于周期表第四周期族ⅣB,故答案为:四;ⅣB;
(2)钛铁矿在高温下与焦炭、氯气反应得到四氯化钛,同时生成氯化铁和CO,反应的化学方程式为2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO;
(3)水解时需加入大量的水并加热,由TiCl4+(2+x) H2O TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全,
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全,
故答案为:由TiCl4+(2+x) H2O TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
(4)在Ar气中进行防止钛、镁被氧化;控制温度使TiCl4、Mg、MgCl2转化为蒸气,Ti不熔化,故温度略高于1412℃蒸馏可分离,
故答案为:防止钛、镁被氧化;蒸馏;1412;
(5)由CO和H2合成甲醇的方程式是CO(g)+2H2(g)?CH3OH(g),合成6mol甲醇需要n(CO)=6mol、n(H2)=12mol.根据2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO可知,电解中生成的n(Cl2)=$\frac{7}{6}$n(CO)=7mol,根据2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑可知,电解生成n(H2)=n(Cl2)=7mol,故需额外补充H2 为12mol-7mol=5mol,
故答案为:CO(g)+2H2(g)?CH3OH(g);5.
点评 本题的综合性很强,侧重分析能力及计算能力的考查,涉及化学反应方程式的书写,燃烧热等多方面内容,注意知识的迁移应用,对学生能力要求较高,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 常温下有下列四种溶液:
常温下有下列四种溶液:| 序号 | ① | ② | ③ | ④ |
| 溶液 | pH=4的NH4Cl溶液 | pH=4的盐酸 | 0.1mol•L-1的醋酸溶液 | 0.1mol•L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2S溶液中加入少量的氯化银:S2-+2Ag+═Ag2S↓ | |
| B. | 向滴有酚酞的1 mol/L硅酸钠溶液中加入稀盐酸至溶液红色消失:SiO${\;}_{3}^{2-}$+2H+═H2SiO3(胶体) | |
| C. | 碳酸氢铵溶液中加入足量NaOH:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | |
| D. | 向苯酚钠溶液中通入一定量CO2: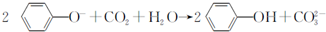 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
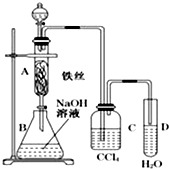 某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、BaSO4 | B. | 铝、二氧化硫 | ||
| C. | 液态的醋酸、酒精 | D. | 熔融的KNO3、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化生成三氧化硫,不采用高压是因为压强对SO2转化率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验现象 | 结论 |
| A | 无色溶液变蓝 | I-在酸性条件下被氧气氧化为I2 |
| B | 溶液均呈红色,且深浅一样 | 相同浓度的CO32-与HCO3-水解能力相同 |
| C | 产生白色沉淀又逐渐变成红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 溴的四氯化碳溶液颜色褪去 | 石蜡催化加热反应产物为乙烯 |
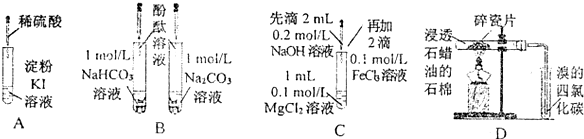
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com