
【题目】下列说法不正确的是
A.光导纤维的主要成分是硅单质B.碳酸氢钠用于治疗胃酸过多
C.硫酸铜可用于游泳池消毒D.过氧化钠可用作漂白剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化合物的化学式为(NH4)2Fe(SO4)2 ,它在水溶液里电离时生成两种阳离子和一种酸根离子
(1)写出硫离子的结构示意图________________;
(2)若向该化合物的水溶液中通入氯气,一种离子很容易被氧化,该离子将变成______;(用离子符号表示)
(3)若向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则该反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应:2A(g)+B(g)![]() 3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol/L的是
3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol/L的是
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用毛笔书写后的纸张作为空气电极,设计并组装了轻型、柔性且可折叠的可充电锂空气电池(图1),电池的工作原理如图2。下列有关说法正确的是
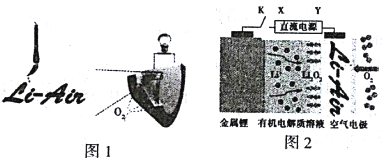
A. 放电时,纸张中的纤维素作锂电池的正极
B. 放电时,Li+由正极经过有机电解质溶液移向负极
C. 开关K闭合给锂电池充电,金属锂电极增重14g,空气电极放出22.4L的O2
D. 充电时,阳极的电极反应式为Li2O2-2e-=O2↑+2Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
(提出猜想)
猜想1:__________________________________;
猜想2:__________________________________;
猜想3:__________________________________。
为了验证猜想,该小组设计实验加以探究。
(实验探究)
该小组同学按如图所示装置,将气体从a端通入。
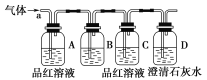
(1)B中应该放________试剂(填编号)。
a.NaCl溶液 B.酸性KMnO4溶液
c.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是_________________________________________。
(3)D中澄清石灰水的作用是_______________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色
②C中品红溶液不褪色
③D中澄清石灰水变浑浊
(得出结论)
(4)由上述现象该小组同学确认该气体为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.丙烯和乙烯都是石油化工最重要的基础原料。主要工业生产途径如下:
途径①CH3CH2CH3(g)![]() CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径②nCH3OH(g)![]() CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9kJ/mol、2056.5 kJ/mol和285.8 kJ/mol,则△H1=_____ kJ/mol。
(2)途径①制备丙烯,要提高丙烯的产率最好采用______条件。(填“高压”或“低压”)
(3)途径②控制适当的条件(温度、压强、催化剂等)可以调节N[N=n(乙烯)/n(丙烯)]在0~1.5之间变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是__________。
②在体积为V的反应器中加入一定量的甲醇,反应1h后,反应器中的压强增加了30%,则甲醇的转化率为______(用N=1进行计算)。
II:(4)含硫煤燃烧产生SO2,利用尿素[CO(NH2)2]水解的溶液可以吸收空气中的SO2。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)
①氨基甲酸铵会与空气中的SO2和O2反应生成(NH4)2SO4,该反应的化学方程式为________。
②-定条件下,用尿素水解液吸收空气中的SO2,测得SO2的吸收率随溶液的温度变化如图甲所示。温度高于60℃时,SO2的吸收率逐渐升高的原因是________。

③尿素溶液吸收SO2的吸收率随溶液的pH变化如图乙所示。尿素深液吸收空气中的SO2后,溶液的pH会降低,为提高SO2的吸收率和充分回收产物,最好向溶液中加入______(填溶液的名称)并控制pH为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量变化的角度来认识,下面说法中,正确的是( )
A.化学变化都是放热的
B.化学变化都是吸热的
C.反应物所含能量等于生成物所含能量
D.化学反应前后反应物和生成物所含能量会发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4↑+10CO↑,上述反应中的各种物质,属于酸性氧化物的有__。
(Ⅱ)(3)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如右图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象:_______,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为__________________.
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com