
分析 CO的转化率为50%,则反应消耗的CO的物质的量为:2mol×50%=1mol,根据反应CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$CH30H(g)分别计算出反应消耗氢气、生成甲醇的物质的量,然后根据c=$\frac{n}{V}$分别计算出平衡时一氧化碳、氢气、甲醇的浓度,最后根据K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$计算出该反应在该温度下的平衡常数.
解答 解:CO的转化率为50%,则反应消耗的CO的物质的量为:2mol×50%=1mol,根据反应CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$CH30H(g)可知,反应消耗氢气的物质的量为1mol×2=2mol,反应生成甲醇的物质的量为1mol,
则达到平衡时各组分的浓度为:c(CO)=$\frac{2mol-1mol}{2L}$=0.5mol/L,c(H2)=$\frac{4mol-2mol}{2L}$=1mol/L,c(CH30H)=$\frac{1mol}{2L}$=0.5mol/L,
所以该温度下该反应的平衡常数为:K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×{1}^{2}}$=1,
故答案为:1.
点评 本题考查了化学平衡常数的计算,题目难度中等,明确化学平衡常数的概念及表达式为解答关键,本题也可以利用三段式计算,试题培养了学生的分析能力及化学计算能力.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:选择题
| A. | 干冰升华克服了分子间作用力,没有破坏共价键 | |
| B. | HCl气体溶于水,形成稀盐酸,仅克服分子间作用力 | |
| C. | C60与金刚石互为同素异形体,它们都属于原子晶体 | |
| D. | 乙醇和二甲醚分子都是C2H6O,它们是同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是有机物 | B. | 都不溶于水 | ||
| C. | 有一种气态物质,其余均是液体 | D. | 除一种外均是四面体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物都能与醋酸发生酯化反应 | |
| B. | 除饱和烃之外的其他烃都能发生聚合反应 | |
| C. | 醇类、卤代烃都能发生消去反应 | |
| D. | 氨基酸、乙酸和苯酚都能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
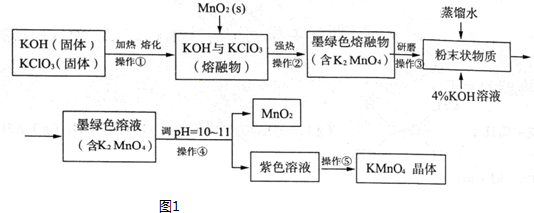
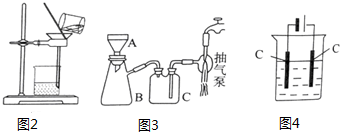
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl水解呈酸性,不能用来当做肥料使用 | |
| B. | 氧化镁的熔点高,可用于制作耐高温的材料 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 水泥、玻璃等硅酸盐材料指的是以二氧化硅为原料生产的材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com