
| A. | 此法的优点之一是原料丰富 | |
| B. | 进行①②③步骤的目的是从海水中提取MgCl2 | |
| C. | 第④步电解时同时会产生氯气 | |
| D. | 以上提取镁的过程中涉及到的反应有分解反应、化合反应和置换反应 |
分析 ①把贝壳制成石灰乳,贝壳分解生成CaO,CaO和水反应生成Ca(OH)2;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,镁离子和氢氧化钙反应生成Mg(OH)2;
③将沉淀物与盐酸反应生成氯化镁,结晶过滤、干燥产物得到MgCl2;
④将得到的产物熔融电解得到镁,反应为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
解答 解:①把贝壳制成石灰乳,贝壳分解生成CaO,CaO和水反应生成Ca(OH)2;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,镁离子和氢氧化钙反应生成Mg(OH)2;
③将沉淀物与盐酸反应生成氯化镁,结晶过滤、干燥产物得到MgCl2;
④将得到的产物熔融电解得到镁,反应为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
A.海水资源丰富,海水中含有大量的镁元素,所以此法的优点之一是原料丰富,故A正确;
B.根据以上分析知,经过①②③步骤可得到MgCl2,故B正确;
C.第④步电解熔融氧化镁,产物为镁和氯气,MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,所以得到Mg的同时得到氯气,故C正确;
D.贝壳分解得到CaO、电解熔融氯化镁都为分解反应,CaO和水生成氢氧化钙为化合反应,该过程中没有置换反应,故D错误;
故选D.
点评 本题考查海水资源综合利用,为高频考点,涉及物质制备、金属冶炼、反应类型判断等知识点,侧重考查学生分析及知识综合运用能力,明确每一步发生的反应及物质性质是解本题关键,知道金属冶炼方法与金属活泼性关系,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:实验题
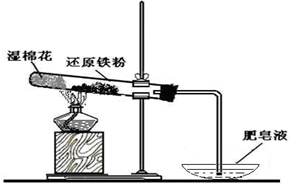
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:H2O>H2S | B. | 碱性:KOH>NaOH | ||
| C. | 酸性:HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5Cl→CH2=CH2 | B. | CH3CHO→C2H5OH | ||
| C. |  | D. | CH3COOH→CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Z的气态氢化物的稳定性在同主族元素中最强 | |
| B. | W的最高价氧化物对应的水化物是强酸 | |
| C. | W的非金属性比Z的弱 | |
| D. | Y的原子半径在同周期主族元素中最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
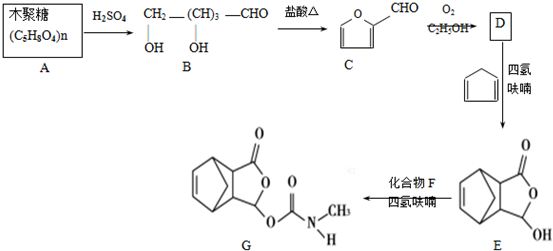
 ,在流程中作反应的催化剂;
,在流程中作反应的催化剂; ;
;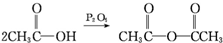 .
. 、CH3NHCOOH.
、CH3NHCOOH. .
. .
.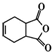 )是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3-丁二烯为原料制备H的合成路线流程图(无机试剂任用):
)是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3-丁二烯为原料制备H的合成路线流程图(无机试剂任用): .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
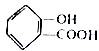
 与
与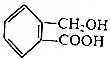 互为同系物
互为同系物 ,请写出将
,请写出将 转化为
转化为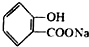 的化学方程式
的化学方程式 +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
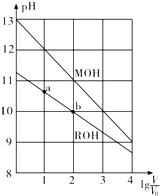
| A. | MOH的碱性强于ROH的碱性 | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 当1g$\frac{V}{{V}_{0}}$=2时,若两溶液同时升温,则$\frac{c({M}^{+})}{c({R}^{+})}$增大 | |
| D. | 若两溶液无限稀释,则它们的c(OH-)相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com