
分析 (1)根据配制一定物质的量浓度的溶液一般步骤选择需要的仪器;
(2)配制一定物质的量浓度溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,据此排序;
(3)①根据溶液稀释过程中溶质硫酸的物质的量不变计算出需要浓硫酸的体积;
②依据浓硫酸稀释产生大量的热,容量瓶在室温下体积准确结合物体热胀冷缩原理解答;
③俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等用到的仪器:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
所以还需要的仪器为:500mL容量瓶、玻璃棒;
故答案为:500mL容量瓶 胶头滴管;
(2)制一定物质的量浓度溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,所以正确的操作顺序为:A、E、F、D、C、B;
故答案为:A、E、F、D、C、B;
(3)①设需要浓硫酸体积为V,则根据溶液稀释过程中溶质硫酸的物质的量不变得:18.4mol/L×V=0.5mol•L-1×500mL,解得V=13.6mL;
故答案为:13.6;
②浓硫酸稀释过程中产生大量的热,要使测量体积准确,则应冷却到室温再移液,否则由于热胀冷原因,定容后,液面下降导致溶液体积偏小,依据C=$\frac{n}{V}$可知溶液浓度偏高;
故答案为:恢复至室温; 高;
③俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$可知,溶液浓度偏高;
故答案为:高.
点评 本题考查一定物质的量浓度溶液配制过程、物质的量浓度有关计算和误差分析等,明确配制原理是解题关键,注意误差分析的方法.


科目:高中化学 来源: 题型:解答题
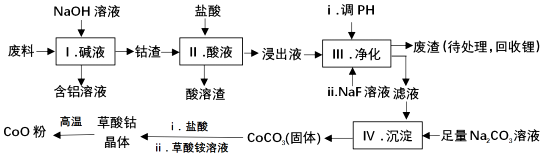
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | Na2S有强还原性 | 用于除去废水中的Cu2+和Hg2+ |
| B | 浓H2SO4有强氧化性 | 浓H2SO4可用于干燥SO2 |
| C | NaHCO3溶于水完全电离 | NaHCO3是强电解质 |
| D | Cl2具有酸性 | Cl2可与石灰乳或烧碱反应制备含氯消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

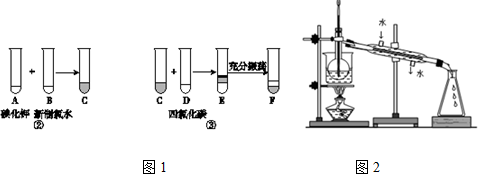
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
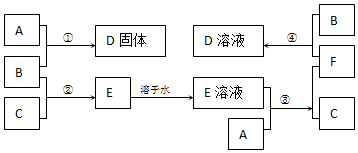
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 | |
| B. | SiO2是非金属氧化物,它不与任何酸反应 | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com