
| 催化剂△ |
| 6.4g |
| 64g/mol |
| 0.1 |
| 2 |
| 催化剂△ |
| 11 |
| 4 |
| 2.75 |
| 0.2 |
| 2 |
| 20.625+2-2.75 |
| 720g |
| 120g/mol |
| b |
| 5 |
| b |
| 5 |
 ;
; .
.

科目:高中化学 来源:2010年江苏省徐州市高三第三次调研考试(化学试题) 题型:填空题
硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。
已知:①550℃时,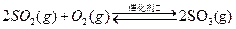
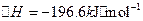
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中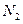 与
与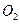 的体积
的体积
比为4:1):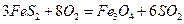 ,
,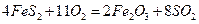
(1) 550℃时,6.4 g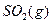 与足量
与足量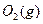 充分反应生成
充分反应生成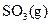 ,放出热量
,放出热量
9.83 kJ
(填“大于”、“等于”或“小于”)o
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 。(填字母)
a.向平衡混合物中充入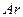 b.向平衡混合物中充入
b.向平衡混合物中充入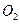
c.改变反应的催化剂 d.降低反应的温度
(3)为使 完全生成
完全生成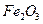 ,生产时要使用过量的
,生产时要使用过量的
空气,则当空气过量50%时,所得炉气中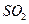 的
的
体积分数是多少?
(4)720 g纯净的 在空气中完全煅烧,所得固体
在空气中完全煅烧,所得固体
中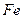 和
和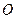 的物质的量之比n(
的物质的量之比n(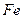 ):n(
):n(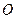 )="6:"
)="6:"  ,
,
此时消耗空气为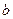 mol。
mol。
①试写出易与口的关系式: 。
②请在右图中画出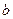 与
与 的关系曲线。
的关系曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。
已知:①550℃时,![]() △H=-196.6KJ.mol-1
△H=-196.6KJ.mol-1
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中N2与O2的体积
比为4:1):![]() ,
,![]()
(1) 550℃时,6.4 g SO2(g)与足量O2(g)充分反应生成SO3(g),放出热量
9.83 kJ (填“大于”、“等于”或“小于”)。
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 。(填字母)
a.向平衡混合物中充入Ar b.向平衡混合物中充入O2
c.改变反应的催化剂 d.降低反应的温度
(3)为使FeS2完全生成Fe2O3,生产时要使用过量的空气,则当空气过量50%时,所得炉气中SO2的体积分数是多少?
(4)720 g纯净的FeS2在空气中完全煅烧,所得固体中Fe和O的物质的量之比n(Fe):n(O)=6: ![]() ,
,
此时消耗空气为![]() mol。
mol。
①试写出a与b的关系式: 。
②请在右图中画出![]() 与
与![]() 的关系曲线。
的关系曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。
已知:①550℃时,![]()
![]()
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中![]() 与
与![]() 的体积
的体积
比为4:1):![]() ,
,![]()
(1) 550℃时,6.4 g ![]() 与足量
与足量![]() 充分反应生成
充分反应生成![]() ,放出热量
,放出热量
9.83 kJ
(填“大于”、“等于”或“小于”)o
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 。(填字母)
a.向平衡混合物中充入![]() b.向平衡混合物中充入
b.向平衡混合物中充入![]()
c.改变反应的催化剂 d.降低反应的温度
(3)为使![]() 完全生成
完全生成![]() ,生产时要使用过量的
,生产时要使用过量的
 空气,则当空气过量50%时,所得炉气中
空气,则当空气过量50%时,所得炉气中![]() 的
的
体积分数是多少?
(4)720 g纯净的![]() 在空气中完全煅烧,所得固体
在空气中完全煅烧,所得固体
中![]() 和
和![]() 的物质的量之比n(
的物质的量之比n(![]() ):n(
):n(![]() )=6:
)=6: ![]() ,
,
此时消耗空气为![]() mol。
mol。
①试写出易与口的关系式: 。
②请在右图中画出![]() 与
与![]() 的关系曲线。
的关系曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。
已知:①550℃时,![]()
![]()
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中![]() 与
与![]() 的体积
的体积
比为4:1):![]() ,
,![]()
(1) 550℃时,6.4 g ![]() 与足量
与足量![]() 充分反应生成
充分反应生成![]() ,放出热量
,放出热量
9.83 kJ
(填“大于”、“等于”或“小于”)o
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 。(填字母)
a.向平衡混合物中充入![]() b.向平衡混合物中充入
b.向平衡混合物中充入![]()
c.改变反应的催化剂 d.降低反应的温度
(3)为使![]() 完全生成
完全生成![]() ,生产时要使用过量的
,生产时要使用过量的
 空气,则当空气过量50%时,所得炉气中
空气,则当空气过量50%时,所得炉气中![]() 的
的
体积分数是多少?
(4)720 g纯净的![]() 在空气中完全煅烧,所得固体
在空气中完全煅烧,所得固体
中![]() 和
和![]() 的物质的量之比n(
的物质的量之比n(![]() ):n(
):n(![]() )=6:
)=6: ![]() ,
,
此时消耗空气为![]() mol。
mol。
①试写出易与口的关系式: 。
②请在右图中画出![]() 与
与![]() 的关系曲线。
的关系曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com