

分析 含Cr2O72-离子的废水加入Na2S2O3溶液调节溶液pH=2-3,重铬酸根离子被还原为Cr3+离子,再加入氢氧化钠溶液控制溶液pH生成Cr(OH)3;
(1)可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子;
(2)每消耗0.1mol Na2S2O3转移0.8mol e-,根据电子转移守恒,可知S2O32-被氧化生成SO42-,而Cr2O72-离子被还原为Cr3+离子,配平书写离子方程式;
(3)Cr(OH)3的化学性质与Al(OH)3相似,显示两性,可以溶解在强酸、强碱溶液中,反应生成NaCrO2与H2O.
解答 解:含Cr2O72-离子的废水加入Na2S2O3溶液调节溶液pH=2-3,重铬酸根离子被还原为Cr3+离子,再加入氢氧化钠溶液控制溶液pH生成Cr(OH)3.
(1)可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子,
A.FeSO4溶液中亚铁离子具有还原性,可以还原Cr2O72-离子,故A符合;
B.浓H2SO4 具有强氧化性,不能表现还原性,不能还原Cr2O72-,故B不符合;
C.酸性KMnO4 是强氧化剂不能还原Cr2O72-,故C不符合;
D.Na2SO3溶液中亚硫酸根离子具有还原性,可以还原Cr2O72-,故D符合;
故答案为:AD;
(2)每消耗0.1mol Na2S2O3转移0.8mol e-,根据电子转移守恒,可知S2O32-被氧化生成SO42-,而Cr2O72-离子被还原为Cr3+离子,配平可得离子方程式为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(3)Cr(OH)3的化学性质与Al(OH)3相似,Cr(OH)3可以溶解在过量的氢氧化钠溶液中,反应生成NaCrO2与H2O,反应离子方程式为:Cr(OH)3+OH-=CrO2-+2H2O,在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,防止Cr(OH)3溶解,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O.
点评 本题考查物质分离提纯的综合应用,涉及对试剂及控制条件的分析评价、氧化还原反应的理解应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
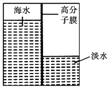 海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管只用水洗 | |
| B. | 锥形瓶只用水洗 | |
| C. | 使用甲基橙做指示剂 | |
| D. | 第一次观察酸式滴定管的刻度时仰视 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
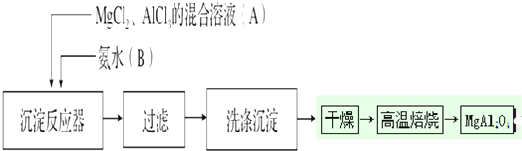
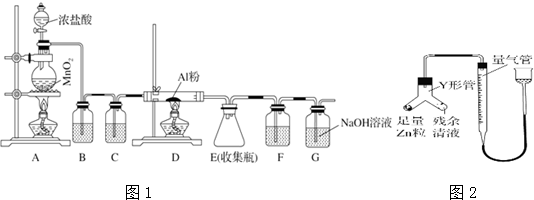
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 碳与SiO2高温反应制粗硅 | ||
| C. | 将锌粒投入Cu(NO3)2溶液 | D. | 镁条在CO2中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com