
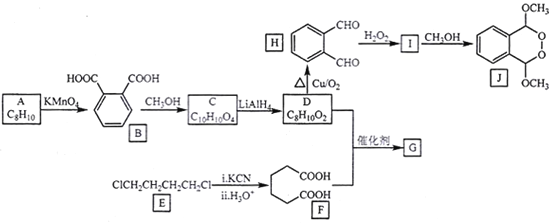
【题目】由A(芳香烃)与E为原料制备J和高聚物G的一种合成路线如下:
已知:①酯能被LiAlH4还原为醇
②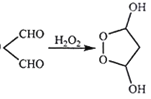
回答下列问题:
(1)A的化学名称是___________,J的分子式为__________,H的官能团名称为___________。
(2)由I生成J的反应类型为___________。
(3)写出F+D→G的化学方程式:______________________。
(4)芳香化合物M是B的同分异构体,符合下列要求的M有______种,写出其中2种M的结构简式:______________。
①1mol M与足量银氨溶液反应生成4 mol Ag
②遇氯化铁溶液显色
③核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比1:1:1
(5)参照上述合成路线,写出用 为原料制备化合物
为原料制备化合物 的合成路线(其他试剂任选)。____________________________________________________。
的合成路线(其他试剂任选)。____________________________________________________。
【答案】邻二甲苯 C10H12O4 醛基 取代反应 n![]() +n
+n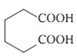
![]()
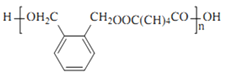 +(2n-1)H2O; 4
+(2n-1)H2O; 4  、
、 、
、 、
、 (任意两种)
(任意两种) 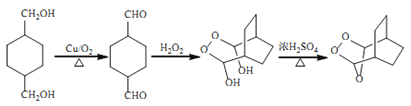
【解析】
A分子式是C8H10,符合苯的同系物通式,结合B的分子结构可知A是邻二甲苯![]() ,邻二甲苯被酸性高锰酸钾溶液氧化为B是邻苯二甲酸
,邻二甲苯被酸性高锰酸钾溶液氧化为B是邻苯二甲酸![]() ,B与甲醇在浓硫酸存在时,加热发生酯化反应产生C是
,B与甲醇在浓硫酸存在时,加热发生酯化反应产生C是![]() ,C在LiAlH4作用下被还原为醇D:
,C在LiAlH4作用下被还原为醇D:![]() ,D被催化氧化产生H:
,D被催化氧化产生H:![]() ,H与H2O2反应产生I:
,H与H2O2反应产生I: ,I与CH3OH发生取代反应产生J:
,I与CH3OH发生取代反应产生J: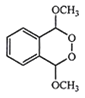 ;D是
;D是![]() ,含有2个醇羟基,F是
,含有2个醇羟基,F是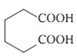 ,含有2个羧基,二者在一定条件下发生酯化反应产生高聚物G:
,含有2个羧基,二者在一定条件下发生酯化反应产生高聚物G: ;(5)
;(5) 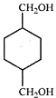 被氧气催化氧化产生
被氧气催化氧化产生 ,
, 与H2O2作用产生
与H2O2作用产生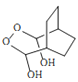 ,
, 在浓硫酸存在时加热,发生反应脱去1个分的水生成
在浓硫酸存在时加热,发生反应脱去1个分的水生成 。据此分析解答。
。据此分析解答。
(1)根据上述分析可知A是![]() ,则A的化学名称是邻二甲苯;J的结构为
,则A的化学名称是邻二甲苯;J的结构为 ,可知J分子式为C10H12O4;H为邻二苯甲醛
,可知J分子式为C10H12O4;H为邻二苯甲醛![]() ,H含有的官能团名称为醛基。
,H含有的官能团名称为醛基。
(2)I结构为 ,与甲醇发生取代反应产生J:
,与甲醇发生取代反应产生J: ,因此由I生成J的反应类型为取代反应;
,因此由I生成J的反应类型为取代反应;
(3)F是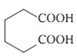 ,D是
,D是![]() ,二者在浓硫酸存在条件下加热,发生酯化反应,形成聚酯G:
,二者在浓硫酸存在条件下加热,发生酯化反应,形成聚酯G: 和水,则由F+D→G的化学方程式为:n
和水,则由F+D→G的化学方程式为:n![]() +n
+n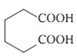
![]()
 +(2n-1)H2O;
+(2n-1)H2O;
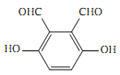
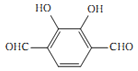
(4)化合物B是邻苯二甲酸![]() ,芳香化合物M是B的同分异构体,符合下列要求:①1 mol M与足量银氨溶液反应生成4 mol Ag,说明分子结构中含有2个醛基;②遇氯化铁溶液显色,说明含有酚羟基;③核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比1:1:1,说明三种H原子的个数相等,则M可能的结构为
,芳香化合物M是B的同分异构体,符合下列要求:①1 mol M与足量银氨溶液反应生成4 mol Ag,说明分子结构中含有2个醛基;②遇氯化铁溶液显色,说明含有酚羟基;③核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比1:1:1,说明三种H原子的个数相等,则M可能的结构为 、
、 、
、 、
、 ,共有4种不同的结构;
,共有4种不同的结构;
(5)以 为原料制备化合物
为原料制备化合物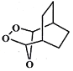 ,首先
,首先 与O2在Cu催化下加热,被氧化为醛
与O2在Cu催化下加热,被氧化为醛 ;反应产生的醛
;反应产生的醛 与H2O2作用产生
与H2O2作用产生 ,得到的
,得到的 在浓硫酸存在时加热,发生分子内的脱水反应生成
在浓硫酸存在时加热,发生分子内的脱水反应生成 。则该合成路线为
。则该合成路线为 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中药丹参中存在丹参醇。一种人工合成丹参醇的部分路线如下:
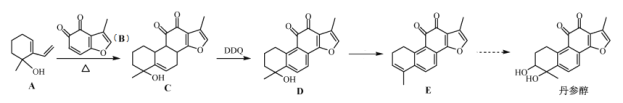
已知:![]()
完成下列填空:
(1)A中官能团的名称:__________________。
(2)D→E的反应条件:___________________。
(3)A和B生成C的反应类型是:______反应。
(4)在铜做催化剂、加热条件下,1mol丹参醇能被_____molO2氧化。
(5)B的分子式是:C9H6O3。符合下列条件的B的同分异构体有__种,写出其中能发生银镜反应的同分异构体的结构简式_____。
①苯环上直接连有一个—OH
②—OH对位上还有一个侧链,该侧链含:—C![]() C—、—COO—。
C—、—COO—。
(6)利用已知条件,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程(无机试剂和乙醇任用,合成路线的表示方式为:甲
的合成路线流程(无机试剂和乙醇任用,合成路线的表示方式为:甲![]() 乙
乙![]()
![]() 目标产物)。_____________
目标产物)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸吡酮洛芬(H)是一种消炎镇痛药,其合成路线如下:
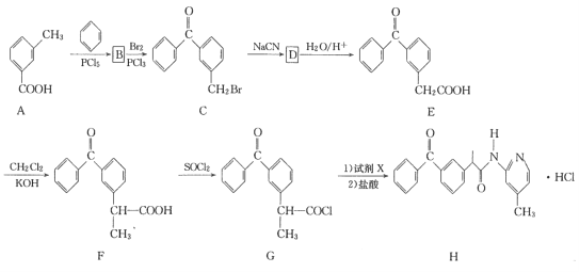
已知R-CN![]() R-COOH
R-COOH
回答下列问题:
(1)A的化学名称是____。
(2)由B生成C的化学方程式为________。
(3)D的结构简式为_______。
(4)F中官能团的名称为_____。
(5)G生成H(试剂X的分子式为C6H8N2)的反应类型是____。
(6)E的分子式为____。X与E互为同分异构体,X的分子中含两个苯环,X水解后产物之一既能发生银镜反应又能与FeCl3溶液发生显色反应,X的核磁共振氢谱显示有6种不同化学环境的氢,峰面积之比为1:2:2:2:2:3。写出符合条件的X的结构简式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法正确的是

A. 两种晶体均为原子晶体
B. 六方相氮化硼层结构与石墨相似却不导电,原因是层状结构中没有自由移动的电
C. 立方相氮化硼含有σ键和π键,所以硬度大
D. 两种晶体中的B原子的杂化类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次递增。其中A是形成化合物种类最多的元素;B原子核外有三个未成对电子;C是元素周期表中电负性最大的元素,化合物D2F为离子晶体,F原子核外的M层中只有两对成对电子;E单质的晶体类型在同周期的单质中没有相同的;G原子最外层电子数与D的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F、G用所对应的元素符号表示):
(1)C元素在元素周期表中的位置为____________________。
(2)D的氯化物的熔点比E的氯化物的熔点_____(填“高”或“低”),理由是_______。
(3)F的低价氧化物分子的立体构型是________,AO2的电子式为___________。
(4)A、B、D、E四种元素第一电离能最大的是_____。
(5)G2+能形成配离子[G(BH3)4]2+.写出该配离子的结构简式(标明配位键)_____。
(6)A能与氢、氧二种元素构成化合物AH2O,其中A原子的杂化方式为_____,1mol该分子中σ键的数目为_____,该物质能溶于水的主要原因是___________________。
(7)G晶体的堆积方式为__________________堆积,配位数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述一定正确的是
A. 在Al3+数目为NA的AlCl3溶液中,Cl-总数为3NA
B. 400mL 1mol/L稀硝酸与Fe完全反应(还原产物只有NO),转移电子数目为0.3NA
C. 0.2mol NH3与0.3mol O2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA
D. pH=1的硫酸溶液中含有SO42-的数目为0.05NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生反应并达到平衡:3X(g)+Y(g)![]() 2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的
2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的![]() ,则下列叙述正确的是
,则下列叙述正确的是
A.升高温度,平衡向正反应方向移动
B.起始时刻n(X) : n(Y)= 2 : 1
C.充入氦气增大容器内的压强,Y的转化率提高
D.若以X表示的反应速率为0.2mol/(L·s),则以Z表示的反应速率为0.3mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子书写正确的是( )
A.碳酸氢钠溶液中加入盐酸:CO32﹣+2H+=CO2↑+H2O
B.向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体: Fe3++ 3H2O ![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C.氢氧化铜与稀硫酸反应:H++OH﹣=H2O
D.澄清的石灰水与碳酸钠溶液反应:CO32﹣+Ca2+=CaCO3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com