
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
| 16.02+16.0+16.01 |
| 3 |
| 0.2000g |
| 134g/mol |
| 2mol |
| c×0.01601L |
| 5mol |
| 0.0015mol |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中由水电离的c(H + ) 一定小于 10 -7 mol/L |
| B、该溶液由0.1 mol?L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合而成 |
| C、该溶液中的溶质可能是CH3COOH和CH3COONa |
| D、在上述溶液中加入适量盐酸,可使溶液中离子浓度改变为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液 | a | b | c | d | e |
| 化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
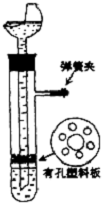 用如图的装置制取氢气,在塑料隔板上放粗锌,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则硫酸由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止.需要时再打开弹簧夹,又可以使氢气发生.这是一种适用于室温下随制随停的气体发生装置.
用如图的装置制取氢气,在塑料隔板上放粗锌,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则硫酸由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止.需要时再打开弹簧夹,又可以使氢气发生.这是一种适用于室温下随制随停的气体发生装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都易发生取代反应 |
| B、都易发生加成反应 |
| C、乙烯和乙炔易发生加成反应,苯只有在特殊条件下才发生加成反应 |
| D、乙烯和乙炔易被氧化剂氧化,苯不易被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com