
【题目】已知H3PO4是一种三元中强酸。25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示。下列说法正确的是
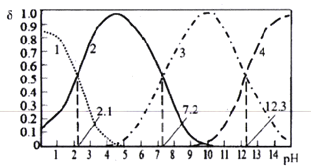
A. 曲线2和曲线4分别表示δ(HPO42-)和δ(PO43-)变化
B. 25℃时,H3PO4的电离常数K1:K2=105.1
C. pH=7.2时,溶液中由水电离出的c(H+)=10-7.2mol/L
D. pH=12.3时,溶液中2c(Na+)=5c(H2PO4-)+5c(HPO42-)+5c(PO43-)+5c(H3PO4)
【答案】B
【解析】
A.某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒为H3PO4、H2PO4-、HPO42-、PO43-,根据pH的变化,可知曲线1为H3PO4,曲线2为H2PO4-,曲线3为HPO42-,曲线4为PO43-,A项错误;
B. H3PO4的第一步电离常数K1=![]() ,25℃时当pH为2.1时,
,25℃时当pH为2.1时,![]() =
=![]() ,故K1=
,故K1=![]() =
=![]() 10-2.1,同理因H3PO4的第二步电离常数K2=
10-2.1,同理因H3PO4的第二步电离常数K2=![]() ,pH=7.2时,
,pH=7.2时, ![]() =
=![]() ,K2=
,K2=![]() =10-7.2,则K1:K2=10-2.1:10-7.2 = 105.1,B项正确;
=10-7.2,则K1:K2=10-2.1:10-7.2 = 105.1,B项正确;
C. pH = 7.2时,溶液中含磷微粒主要为:H2PO4-、HPO42-,此时溶液中的c(H+)=10-7.2 mol/L,水的电离受到一定程度的抑制, H2PO4-、HPO42-及水电离的氢离子浓度共10-7.2 mol/L,则溶液中由水电离出的c(H+)小于10-7.2mol/L,C项错误;
D. pH=12.3时,溶液中主要含Na3PO4与Na2HPO4,依据越弱越水解的原理可知,PO43-水解程度较HPO42-大,又因为此时![]() =
=![]() ,则说明Na3PO4与Na2HPO4并非相同浓度,故物料守恒式不正确,D项错误;
,则说明Na3PO4与Na2HPO4并非相同浓度,故物料守恒式不正确,D项错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.向等质量的Na2CO3和NaHCO3 固体中分别加入足量盐酸,后者产生的CO2多
C.可用相同的离子方程式表示Na2CO3和NaHCO3分别与硝酸的反应
D.某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如下图所示,M、N为离子交换膜。

下列说法错误的是
A. 阴极室发生的反应为2H++2e-=H2↑
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜(BP),阳极室会有C12生成
D. 电路中每转移1mol电子,两极共得到0.5 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molAlCl3在熔融状态吋含有的离子总数为0.4NA
B. 某温度下纯水的pH=6,该温度下10LpH=11的NaOH溶液中含OH-的数目为NA
C. 8.7g二氧化锰与含有0.4molHCl的浓盐酸加热充分反应,转移电子的数目为0.2NA
D. 12g金刚石中C-C键的数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着石油资源的日益枯竭,天然气的廾发利用越来越受到重视。CH4/CO2催化重整制备合成气(CO和H2)是温室气体CO2和CH4资源化利用的重要途径之一,并受了国内外研究人员的高度重视。回答下列问题:
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CH4/CO2催化重整反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
该催化重整反应的△H=______kJ·mol-1。要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为_____。
(2)向2L刚性密闭容器中充入2molCH4和2mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数(![]() )随温度变化如下表所示。
)随温度变化如下表所示。

已知b>a>c,则T1______T2(填“>”“<”或“=”)。T1下该反应的平衡常数K=_______(mol2·L-2)
(3)实验硏究表明,载体对催化剂性能起着极为重要的作用,在压强0.03MPa,温度750℃条件下,载体对镍基催化剂性能的影响相关数据如下表:

由上表判断,应选择载体为_______(填化学式),理由是________。
(4)现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均充入2mol CH4(g)和2 molCO2(g)进行反应,三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的情况下,反应均进行到tmin时,CO2的体积分数如图所示,此时I、Ⅱ、Ⅲ个容器中一定处于化学平衡状态的是_______。

(5)利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g)![]() CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:

该反应速率的通式为ν正=k正cm(CO)·cn(H2)(k正是与温度有关的速率常数)。由表中数据可确定反应速率的通式中n=____(取正整数)。若该温度下平衡时组别1的产率为25%,则组别1平衡时的v正=______(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中所含原子数相同的是( )
A. 10gH2和10gO2B. 5.6LN2(标准状况)和11gCO2
C. 9gH2O和0.75molBr2D. 224mLH2(标准状况)和0.1molN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:(1) FeCl3净水的原理是_______;FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)________。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为____。
(3)FeCl3在溶液中分三步水解:Fe3++H2O![]() Fe(OH)2++H+ K1 ;
Fe(OH)2++H+ K1 ;
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2;
Fe(OH)2++H+ K2;
Fe(OH)2++H2O![]() Fe(OH)3+H+ K3。
Fe(OH)3+H+ K3。
以上水解反应的平衡常数K1、K2、K3由小到大的顺序是_____;
(4)通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____;
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____;
A.降温 B.加水稀释 C.加入NH4Cl D.加入NaHCO3
(5)室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)是具有强还原性的弱酸,可以被银离子氧化为磷酸。1摩尔亚磷酸最多消耗2摩尔氢氧化钠。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________。
(2)Na2HPO3是____(填“正盐”或“酸式盐”) 。
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________。
(4)某温度下,0.10 molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2 molL-1,该温度下H3PO3的电离平衡常数K1=___________________;(结果保留两位有效数字)。
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com