

���� ��������ͼ��֪������ʯ����Ҫ�ɷ�MgCO3•CaCO3����SiO2�����ʣ���ľ��Һ����Ҫ�ɷ����ᣩ��Ӧ���ɴ���ƺʹ���þ�����˵�����1Ϊ�������裬��Һ����Ҫ�����Ǵ���ƺʹ���þ���������̼��ɫ���ټ�������þ��������Һ��n��Ca����n��Mg����ֵ�����ˣ���ȥ���Һ�й������ʣ��ô���ƺʹ���þ��Һ������Һ�����ᾧ�����ˡ�ϴ�Ӽ������CMA��
��1�������MgCO3•CaCO3��CH3COOH�ķ�Ӧ���ɴ���ƺʹ���þ��
��2����֪lmol NaOH��������跢����Ӧʱ�ų�����ΪQkJ����Ӧ���Ȼ�ѧ����ʽΪSi02��s��+2NaOH��aq��=Na2SiO3��aq��+H2O��l������H=-2QkJ/mol��
�����������Һ���ʺ�ɫ����ɫ����ľ��Һ�к�����������ɫ�Ľ����й��⣬������ɫ����һ��Ҫԭ����ʵ������б��ӱ������������������ղ�����ɫ���ʣ�
��3��������ͼ2��ʾ�ơ�þ�����ʵ���֮�����ˮ�ʣ�����ѩЧ�������ȣ���ϵ����֪����n��Ca����n��Mg��ԼΪ3��7ʱ����ˮ����ߣ�
��4����������ķ�����֪������ް����IJ����� �����ᾧ�����ˡ�ϴ�Ӽ����
��5��ȡakg��MgC03•CaC03��������Ϊb%�İ���ʯ���������������Ʊ�CMA����֪MgC03'•CaC03����ʧ��Ϊc%����ɵ�n��Ca��CH3COO��2��=$\frac{a��b%��1-c%��}{184}$��103mol��
n��Mg��CH3COO��2��=$\frac{a��b%��1-c%��}{184}$��103��$\frac{7}{3}$mol�������֮��ƷCMA����ʧ��Ϊd%���Դ˼��������
��� �⣺��1������ٷ����ķ�Ӧ���ӷ���ʽΪ MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2��+2H2O��
�ʴ�Ϊ��MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2��+2H2O��
��2����֪lmol NaOH��������跢����Ӧʱ�ų�����ΪQkJ����Ӧ���Ȼ�ѧ����ʽΪSi02��s��+2NaOH��aq��=Na2SiO3��aq��+H2O��l������H=-2QkJ/mol��
�����������Һ���ʺ�ɫ����ɫ����ľ��Һ�к�����������ɫ�Ľ����й��⣬������ɫ����һ��Ҫԭ����ʵ������б��ӱ������������������ղ�����ɫ���ʣ�
�ʴ�Ϊ��Si02��s��+2NaOH��aq��=Na2SiO3��aq��+H2O��l����H=-2QkJ/mol��ʵ������б��ӱ������������������ղ�����ɫ���ʣ�
��3��������ͼ2��ʾ�ơ�þ�����ʵ���֮�����ˮ�ʣ�����ѩЧ�������ȣ���ϵ����֪����n��Ca����n��Mg��ԼΪ3��7ʱ����ˮ����ߣ����Բ���ܵ�Ŀ�ij�����n��Ca����n��Mg��ԼΪ3��7��������м�������þ��Ŀ���ǵ��ڸơ�þ���ӵ����ʵ���֮�ȣ���ȥ���������ᣬ
�ʴ�Ϊ��C����ȥ���������
��4����������ķ�����֪������ް����IJ����� �����ᾧ�����ˡ�ϴ�Ӽ����
�ʴ�Ϊ�������ᾧ��
��5��ȡakg��MgC03•CaC03��������Ϊb%�İ���ʯ���������������Ʊ�CMA����֪MgC03'•CaC03����ʧ��Ϊc%����ɵ�n��Ca��CH3COO��2��=$\frac{a��b%��1-c%��}{184}$��103mol��
n��Mg��CH3COO��2��=$\frac{a��b%��1-c%��}{184}$��103��$\frac{7}{3}$mol�������֮��ƷCMA����ʧ��Ϊd%�����֪���ò�Ʒ����ԼΪ��[$\frac{a��b%��1-c%����158}{184}$+$\frac{a��b%��1-c%����\frac{7}{3}��142}{184}$]����1-d%����
�ʴ�Ϊ��[$\frac{a��b%��1-c%����158}{184}$+$\frac{a��b%��1-c%����\frac{7}{3}��142}{184}$]����1-d%����
���� ���⿼��CMA�Ĺ������̣����ؿ���ѧ���Ķ���Ŀ��ȡ��Ϣ�������Թ������̵����⡢���ʷ����ᴿ���������Ƶȣ��ۺ��Խ�ǿ����Ŀ�Ѷ��еȣ���Ҫѧ���߱���ʵ�Ļ���֪ʶ���ۺ�����֪ʶ����Ϣ���н�������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� | B�� | ���� | C�� | �ƾ� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�
������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�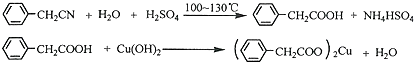
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

| ���� | �۵�/�� | �е�/�� | �ܽ��� |
| �������� | 114.3 | 305 | ������ˮ����������ˮ |
| ���� | -6 | 184.4 | ����ˮ |
| ���� | 16.6 | 118 | ������ˮ |
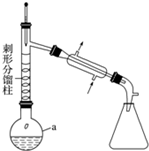
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
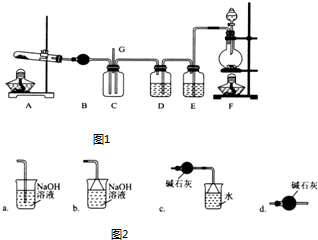
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
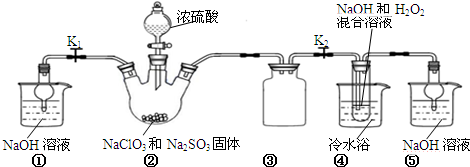
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.25mol | B�� | 0.125mol | C�� | 0.1mol | D�� | 0.5mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com