
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是__________________________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。

(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)
【答案】(1)Ca 2
(2)H2O分子间存在氢键
(3)F>N>O
(4)3d104s1
(5)三角锥形 sp3
(6) 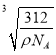
【解析】根据题意及电子排布式的规律判断可知,元素A、B、C、D、E分别是N、O、F、Ca、Cu。(1)A单质是N2,其结构式是NN,含有两个π键。(2)由于H2O的分子间有氢键,使得其沸点是同族元素氢化物中最高的。(3)N的2p能级是半充满状态,比较稳定,其第一电离能比O要大,但比同周期的F要小。(5)NH3的空间构型是三角锥形,其中N是sp3杂化。(6)根据晶胞的结构,应用“均摊法”计算可得,1个晶胞中含有4个Ca2+,8个F-,故其密度为ρ=(312/NA)÷a3,解得a= 。
。
点拨:本题考查物质结构的推断,考查考生应用所学知识灵活解决问题的能力。难度中等。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】MnSO4·H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:

下列说法错误的是
A. 装置I烧瓶中放入的药品X为铜屑
B. 装置II中用“多孔球泡”可增大SO2的吸收速率
C. 装置III用于吸收未反应的SO2
D. 用装置II反应后的溶液制备MnSO4·H2O需经历蒸发结晶、过滤、洗涤及干燥的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气法制取甲醇(CH3OH)的反应及其反应的焓变、平衡常数如下:
① CH4(g) + 1/2 O2(g)![]() CO(g) + 2H2(g)
CO(g) + 2H2(g) ![]() H1 =-35.4kJ·mol-1 平衡常数K1
H1 =-35.4kJ·mol-1 平衡常数K1
② CO(g) + 2H2(g) ![]() CH3OH (g)
CH3OH (g) ![]() H2 =-90.1 kJ·mol-1 平衡常数K2
H2 =-90.1 kJ·mol-1 平衡常数K2
③ 2CH4(g) + O2(g) ![]() 2CH3OH(g)
2CH3OH(g) ![]() H3 平衡常数K3
H3 平衡常数K3
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________。
(2)依据盖斯定律求出反应③ 2CH4(g) + O2(g) ![]() 2CH3OH(g)
2CH3OH(g) ![]() H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
(3)下列关于化学反应中的能量及变化理解错误的是(填字母序号)______。
a.反应中活化能的作用是使反应物活化,从而启动反应或改变反应速率
b.化学键的断裂与形成一定伴随着电子的转移和能量变化
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(![]() H)决定
H)决定
d.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
e.200℃、101kPa时,1 mol H2和碘蒸气作用生成HI的反应,热化学方程式表示如下:
H2(g)+I2(g) === 2HI(g) ![]() H3 = -14.9 kJ·mol-1
H3 = -14.9 kJ·mol-1
f.燃烧热定义中“生成稳定的氧化物”,意味着这些氧化物不能再燃烧了
(4)甲醇燃料电池的种类很多,我们常用的一种甲醇燃料电池,是以甲醇与氧气的反应为原理设计的,其电解质溶液是KOH溶液。该电池负极的电极反应式为_____________________________。
如图是自呼吸式甲醇燃料电池工作示意图。图中进入c口的物质可能是______________,若有16g甲醇参与原电池反应,理论上电池内部有___________mol 质子通过质子交换膜。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是
A. 0.1 mol N2与足量的Mg完全反应,生成物中阴离子数为0.1 NA
B. 1 mol C2H5OH被O2完全氧化为CH3CHO,减少2 NA个C-H键
C. 2.24 L Cl2与足量NaOH溶液反应,转移的电子数目为0.1 NA
D. 1.0 g由H218O与D216O(1∶1)组成的混合物中所含中子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可以通过电解法进行制备,装置如图所示,下列说法错误的是
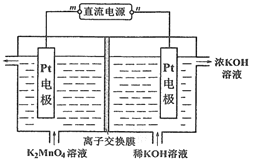
A. 阳极的电极反应式:MnO42- – e-= MnO4-
B. 该装置的离子交换膜为阳离子交换膜
C. 当电路通过a mol电子时,阴极室电解质溶液增加2a mol离子
D. 若电解流出液中KMnO4、K2MnO4和KOH物质的量之比为a∶b∶c,则流进电解池的电解液中K2MnO4和KOH的物质的量之比为 (a + b)∶( c + a )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:i. ![]()
ii. 
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1) A的名称是_______________;C的官能团的名称是_______________。
(2) B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_______________。
(3) E分子中含有两个酯基,且为顺式结构,E的结构简式为_______________。
(4)反应①的化学方程式为_______________________。
(5)试剂a的结构简式为_______________;反应②所属的反应类型为____________反应。
(6)已知Q为G的同分异构体,同时满足下列条件Q的个数为_______(不考虑立体异构)。
①1 mol Q可与足量的NaHCO3溶液反应生成1 mol CO2
②能发生银镜反应
③苯环上有三条支链
(7)已知氨基(-NH2)与-OH类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol/L H2A溶液中存在H2A、HA和A2-三种形态的粒子,其物质的量分数δ(x)随溶液PH变化的关系如图所示[已知δ(x)=c(X)/(C(H2A)+ C(HA-)+C(A2-)),下列说法不正确的是(图中a=1.35、b=4.17)

A. PH=7的溶液中C(Na+)=2[(C(A2-)+C(HA-)+C(H2A)]
B. 0.lmol/LNaHA溶液中C(OH-)+C(A2-)=C(H+)+C(H2A)
C. 已知Pka=-1gKa,则Pka2=4.17
D. PH=3的溶液中C(HA-)>C(A2-)+C(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某酸(HA) 溶液中逐滴加入0.1mol/L的氨水,所得溶液的pH及导电能力与加入氨水的体积关系如图所示。下列说法中不正确的是

A. HA为弱酸
B. b点对应溶液pH=7,此时HA溶液与氨水恰好完全反应
C. c点对应的溶液存在c(OH-)=c(H+)+c(HA)
D. a、b、c三点中,b点对应的溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+ B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA—A和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a-b)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com