
【题目】对于下列实验,能正确描述其反应的离子方程式是
A.用Na2SO3溶液吸收少量Cl2:3![]() +Cl2+H2O = 2
+Cl2+H2O = 2![]() +2
+2![]() +
+![]()
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2=O2↑+2H++2Fe2+
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:![]() +OH-=NH3·H2O
+OH-=NH3·H2O
【答案】A
【解析】
A.用Na2SO3溶液吸收少量的Cl2,Cl2具有强氧化性,可将部分![]() 氧化为
氧化为![]() ,同时产生的氢离子与剩余部分
,同时产生的氢离子与剩余部分![]() 结合生成
结合生成![]() ,Cl2被还原为Cl-,反应的离子反应方程式为:3
,Cl2被还原为Cl-,反应的离子反应方程式为:3![]() +Cl2+H2O=2
+Cl2+H2O=2![]() +2Cl-+
+2Cl-+![]() ,A选项正确;
,A选项正确;
B.向CaCl2溶液中通入CO2,H2CO3是弱酸,HCl是强酸,弱酸不能制强酸,故不发生反应,B选项错误;
C.向H2O2中滴加少量的FeCl3,Fe3+的氧化性弱于H2O2,不能氧化H2O2,但Fe3+能催化H2O2的分解,正确的离子方程式应为2H2O2![]() 2H2O+O2↑,C选项错误;
2H2O+O2↑,C选项错误;
D.NH4HSO4电离出的H+优先和NaOH溶液反应,同浓度同体积的NH4HSO4溶液与NaOH溶液混合,氢离子和氢氧根恰好完全反应,正确的离子反应方程式应为:H++OHˉ=H2O,D选项错误;
答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以酚酞为指示剂,用0.1000 mol·L1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数![]() 随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2的分布系数:
随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2的分布系数:![]() ]
]

下列叙述正确的是
A. 曲线①代表![]() ,曲线②代表
,曲线②代表![]()
B. H2A溶液的浓度为0.2000 mol·L1
C. HA的电离常数Ka=1.0×102
D. 滴定终点时,溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示。在下列因素中对产生H2速率没有影响的是
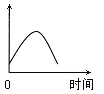
A.H+的浓度B.镁条的表面积C.溶液的温度D.Cl—的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应某时刻t时,n t (N2) = 13 mol,n t (NH3) = 6 mol,则a =____mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量_____;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =______;
(4)原混合气体中,a∶b =_____;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= ______;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1mol有机物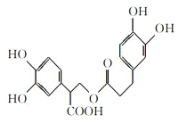 在一定条件下能和7molNaOH反应
在一定条件下能和7molNaOH反应
B.![]() 所有碳原子可能都在同一平面上
所有碳原子可能都在同一平面上
C.分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物的结构有3种
D.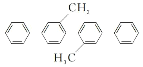 的一氯代物有9种(不考虑立体异构)
的一氯代物有9种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)从煤油中取出一块钠,用滤纸吸净其表面的煤油,用小刀切下一小块,钠块表面很快变暗,该反应的氧化产物为__________;将一小块钠放入坩埚中加热,反应现象为:________________________,反应的化学方程式是______________________。以上反应表明金属钠具有强的______性(填“氧化”或 “还原”)。
(2)铝和氢氧化钠反应的化学方程式为:___________________________________;如果产生的气体在标准状态下的体积为2.24L,即反应转移的电子数为____NA;
(3)已知: Fe2O3+2Al![]() Al2O3+2Fe,该反应中作为还原剂的是________,还原产物是 _______;标出电子转移的方向和数目_______________________________。
Al2O3+2Fe,该反应中作为还原剂的是________,还原产物是 _______;标出电子转移的方向和数目_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
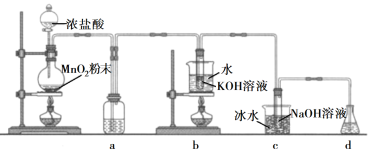
回答下列问题:
(1)盛放MnO2粉末的仪器名称是________,a中的试剂为________。
(2)b中采用的加热方式是_________,c中化学反应的离子方程式是________________,采用冰水浴冷却的目的是____________。
(3)d的作用是________,可选用试剂________(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,________,__________,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力____NaClO(填“大于”或“小于")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列三个反应的叙述,正确的是( )
①2H2S+SO2=3S↓+2H2O
②S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
③3S+6KOH![]() 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
A.反应①说明SO2能与酸反应,具有碱性氧化物的性质
B.反应②改用稀H2SO4,则能放出氢气
C.反应②和③说明S具有两性元素的性质
D.反应③说明S既具有氧化性又具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究无机盐X(仅含三种元素,摩尔质量为270g·mol-1)的组成和性质,某学习小组进行了如下实验,其中气体单质A能使带火星的木条复燃。
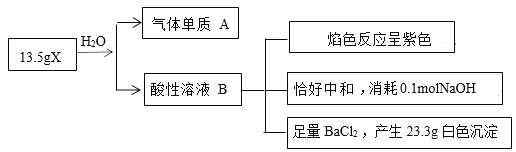
(1)X的组成元素为O和______(用元素符号表示)。
(2)写出X与水反应的化学反应方程式__________。
(3)X氧化能力极强,且对环境友好,可用于脱硫、脱硝。在碱性条件下,X氧化SO32-的离子方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com