
一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:
CO(g)+Cl2(g) COCl2(g)
COCl2(g)
其中容器Ⅰ中5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ中加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO的转化率大于80%
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源:2017届云南省昆明市新课标高三月考卷(六)理综化学试卷(解析版) 题型:选择题
某化工厂为了综合利用生产过程中生成的CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:

下列有关说法错误的是
A. 将滤液蒸干,即可提取产品(NH4)2SO4
B. 通入足量氨气使悬浊液呈碱性有利于CO2的吸收
C. 副产品是生石灰,X是CO2,其中CO2可循环利用
D. 沉淀池中发生的主要反应为CaSO4+CO2+2NH3+H2O CaCO3↓+(NH4)2SO4,
CaCO3↓+(NH4)2SO4,
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省揭阳市高二下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式__________,____________。
(2)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是_________(填元素符号),第一电离能最大的是_________(填元素符号)。该晶体中的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(4)氨的沸点_________(填“高于”或“低于”)膦(PH2),原因是_____________。
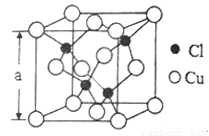
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。
查看答案和解析>>
科目:高中化学 来源:2017届江西省、临川一中高三1月联考理综化学试卷(解析版) 题型:选择题
等体积浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液混合,①、②分别与③混合,实验测得产生的CO2气体体积(V)随时间(t)的变化如图所示,下列说法正确的是( )

A. 三种溶液pH的比较③>②>①
B. 反应结束后所得两溶液中,c(CH3COO-)>c(SCN-)
C. 上述三种溶液中水电离的电离度:NaHCO3>CH3COOH>HSCN
D. ①与③反应所得的溶液中:c(CH3COO-) + c(CH3COOH) = 0.1mol/L
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:简答题
I.锰是在地壳中广泛分布的元素之一,其单质和化合物在工农业生产中有着重要的作用。已知Al的燃烧热为ΔH=—ckJ·mol—1,金属锰可用铝热法制得。其余相关热化学方程式为:3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) ΔH1 = akJ·mol—1
3MnO2(s)=Mn3O4(s)+O2(g) ΔH2 = b kJ·mol—1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) ΔH3 =__________kJ·mol—1(用含a、b、c的式子表示)
II.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
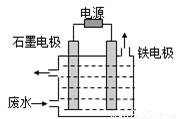
(1)电解处理法:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极”或“阳极”),阳极产生ClO-的电极反应为__________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH—=4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
①废水中的CN一经以下反应实现转化:CN—+H2O2+H2O=A+NH3↑,则A是__________(用符号表示)。
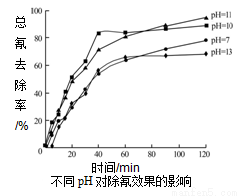
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为__________(a.7-10;b.10-11;c.11-13),解释该pH不宜太大的原因__________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是

A. 反应①、反应②均为放热反应
B. 反应①、反应②均为氧化还原反应
C. 反应①比反应②的速率慢,与相应正反应的活化能无关
D. 反应①、反应②的焓变之和为ΔH=-218kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
下列有关物质的性质与用途具有对应关系的是
性质 | 用途 | |
A | 液氨气化吸热 | 可用作制冷剂 |
B | NH4HCO3受热易分解 | 可用作氮肥 |
C | 二氧化硅能与HF反应 | 可用作光导纤维 |
D | 二氧化硫能使溴水褪色 | 可用作漂白剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
常温下,对于1L0.1mol/L的醋酸溶液,下列判断不正确的是
A. 该溶液的PH大于1
B. c(OH-)=c(H+)-C(CH3COO-)
C. 与等体积、等浓度的NaOH溶液完全中和后,溶液显中性
D. 与足量锌反应比等体积、等浓度的盐酸反应速率慢,生成氢气的质量相等
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三2月联考化学试卷(解析版) 题型:简答题
A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。请回答下列问题:
(1)写出:B的元素符号________________,D的原子结构示意图_____________________,E的最高价含氧酸的化学式_______________________。
(2) E元素+1价含氧酸的电子式为:_________________。
(3)写出A、B两元素最高价氧化物对应的水化物相互反应的化学方程式
__________________________________________________。
(4) D、E最高价氧化物对应水化物的酸性较弱为_________________。(用化学式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com