
二元弱酸是分步电离的,25时碳酸和草酸的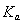 如下表:
如下表:
H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2 |
Ka2=5.6×10-11 | Ka2=5.42×10-5 |
(1)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液??????? B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液???????? D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示。
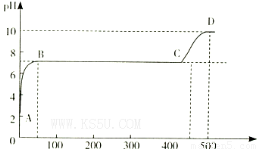
刚开始滴人碳酸钠溶液时发生反应的离子方程式为_________,BC段发生反应的离子方程式为_____,D点时混合溶液中由水电离产生的c(H+)=_________ mol/L。
(1)B?? C?? (2)2H++CO32-=H2O+CO2↑? Ca2++CO32-=CaCO3↓?? 10-4
【解析】
试题分析:(1)因为H2C2O4的二级电离平衡常数Ka2=5.42×10-5> H2CO3的二级电离平衡常数Ka2=5.6×10-11。所以在这四种溶液c(H+)最大的是0.1 mol/L的NaHC2O4溶液。正确选项为B.电离平衡常数越小,其钠盐水解的程度就越大。溶液的碱性就越强。由于Ka2(H2C2O4)=5.42×10-5> 5.6×10-11= Ka2(H2CO3),所以c(OH-)最大的是0.1 mol/L的Na2CO3溶液。正确选项为C.(2)在反应开始时由于溶液的pH略大于2,说明溶液中含有过量稀盐酸电离产生大量的H+。此时滴入碳酸钠溶液时发生反应的离子方程式为2H++CO32-=H2O+CO2↑;在PH=7,溶液呈中性时发生的反应为CaCl2+Na2CO3=2NaCl+ CaCO3↓.反应的离子方程式为Ca2++CO32-=CaCO3↓。当该反应发生完全后继续加入Na2CO3,则是Na2CO3和NaCl的混合溶液。NaCl是强酸强碱盐,不发生水解反应,而Na2CO3是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,使溶液显碱性。在D点溶液的pH=10,则c(H+)=10-10mol/L.由于H+you 消耗,所以水电离产生的OH-的浓度为:c(OH-)=Kw÷c(H+)=10-4mol/L.所以c(H+)(水)= c(OH-)(水)= 10-4mol/L。
考点:考查盐的水解、电离平衡常数及图像法的应用。主要包括盐溶液中的c(H+)、c(OH-)\的比较及混合溶液中离子方程式的书写及盐水解时水电离产生的离子浓度的问题。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
| c2(SO3) |
| c2(SO2)×c(O2) |
| c2(SO3) |
| c2(SO2)×c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
①HA+HC2-(少量)![]() A-+H
A-+H
②H2B(少量)+![]() B2-+
B2-+
③H2B(少量)+H![]() HB-+H
HB-+H
完成下列问题:
(1)相同条件下,HA、H2B、H
(2)A-、B2-、C3-、HB-、H
(3)下列反应的离子方程式中正确的是______________ (填写标号)。
A.H![]()
B.HB-+A-![]() HA+B2-
HA+B2-
C.H![]() HB-+H
HB-+H
(4)完成下列反应的离子方程式:
A.H![]() __________________________________;
__________________________________;
B.2HA(过量)+C3-![]() ____________________________________。
____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……
今有HA、H2B、H3C三种一元、二元、三元弱酸,
根据“较强酸 + 较弱酸盐= 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应:
① HA + HC2-(少量)= A- + H2C-;
② H2B(少量)+2A- = B2- + 2HA;
③ H2B(少量)+ H2C- = HB- + H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是_________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是_____,最难结合质子的是_____。
(3)完成下列反应的离子方程式
④ H3C + A-:_____________________;⑤ HB- + A-:______________________;
⑥ H3C + B2-:_____________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012年黑龙江双鸭山一中高二上学期期中考试化学试卷 题型:填空题
(12分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……
今有HA、H2B、H3C三种一元、二元、三元弱酸,
根据“较强酸 + 较弱酸盐 = 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应:
① HA + HC2-(少量)= A- + H2C-;
② H2B(少量)+2A- = B2- + 2HA;
③ H2B(少量)+ H2C- = HB- + H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是_________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是_____,最难结合质子的是_____。
(3)完成下列反应的离子方程式
④ H3C + A-:_____________________;⑤ HB- + A-:______________________;
⑥ H3C + B2-:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com