
| A. | MgBr2和KCl | B. | Cl2和HCl | C. | HI和NaI | D. | Na2O2和H2O2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键,同种非金属元素之间形成非极性共价键、不同非金属元素之间形成极性共价键,据此分析解答.
解答 解:A.MgBr2和KCl中只存在阴阳离子形成的离子键,所以化学键类型相同,故A正确;
B.Cl2是共价键,而HCl中氢原子与氯原子之间只存共价键,但前者是非极性共价键、后者是极性共价键,所以化学键类型不相同,故B错误;
C.HI中H原子和I原子之间存在极性键,NaI中钠离子和碘离子之间存在离子键,所以化学键类型不相同,故C错误;
D.Na2O2中存在离子键和共价键、H2O2中只存在共价键,所以化学键类型不同,故D错误;
故选A.
点评 本题考查了化学键的判断,根据物质的构成微粒及微粒间的作用力来分析解答,知道离子键、共价键的区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
 它的名称为( )
它的名称为( )| A. | 3,3-二甲基-2-乙基-戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2,3,3-三甲基戊烷 | D. | 3,3,4-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.2 g | B. | 16.7 g | C. | 12.6g | D. | 12 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
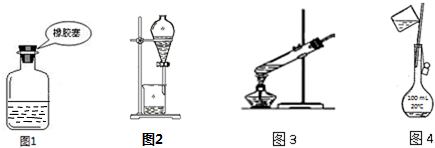
| A. | 图1装置:存放NaOH溶液 | |
| B. | 图2装置:分离乙酸乙酯和水 | |
| C. | 图3装置:葡萄糖的银镜反应 | |
| D. | 图4装置:配制 100 mL 1 mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com