
【题目】对于物质的量相同的H2SO4和H3PO4,下列说法不正确的是
A.分子个数相等B.含有的氧原子数相等
C.含有的氢原子数相等D.质量相等
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离NaCl和BaCl2两种固体混合物,回答下列问题:
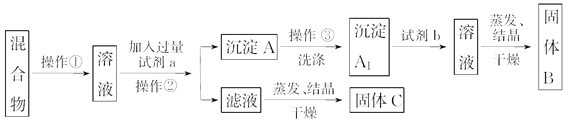
供选试剂:Na 2CO3溶液、Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是______________。
(2)试剂a是________(填化学式,下同),试剂b是____________,固体B是________。
(3)加入试剂a所发生的化学反应方程式为_______________________________________。
(4)简述洗涤的操作步骤____________________________________________________________。
(5)该方案能否达到实验目的?___________。若不能,应如何改进(若能,此问不用回答)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g·mL-1,质量分数为ω,物质浓度为c mol·L1,则下列关系中正确的是( )
A. c=![]() B. ω=
B. ω=![]() C. ω=
C. ω=![]() D. ρ=
D. ρ=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
A. x的值为2 B. A的转化率为60%
C. B的平衡浓度为0.8 mol/L D. D的体积分数为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某有机物分子中只含有C、N、H三种元素,以n(C)、n(N)分别表示C、N的原子数目,则H原子数最多为 ( )
A. 2n(C)+2+n(N) B. 2n(C)+2+2n(N)
C. 2n(C)+1+2n(N) D. 3n(C)+2n(N)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列有关问题。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________,温度升高后,K 值________(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________,温度升高后,K 值________(填“增大”、“不变”或“减小”)。
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) H1= +489.0kJ/mol
②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H2= -28.5kJ/mol
2Fe(s)+3CO2(g) H2= -28.5kJ/mol
③C(石墨)+ CO2(g) = 2CO(g) H3= akJ/mol ,
则a=__________kJ/mol。
(3)在T℃时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为_______。
②下列情况标志反应达到平衡状态的是________(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CrSi、Ge-GaAs、ZnGeAs2、聚吡咯、碳化硅和氧化亚铜都是重要的半导体化合物。回答下列问题:
(1)基态铬原子的核外电子排布式为___________,其中未成对电子数为____________。
(2) Ge-GaAs中元素Ge、Ga、As的第一电离能从大到小的顺序为_______________。ZnGeAs2中Zn、Ge、As的电负性从大到小的顺序为________________。
(3)聚吡咯的单体为吡咯(![]() ),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
(4)碳化硅、晶体硅及金刚石的熔点如下表:
立方碳化硅 | 晶体硅 | 金刚石 | |
熔点/℃ | 2973 | 1410 | 3550~4000 |
分析熔点变化规律及其差异的原因:__________________________________________________。
(5)氧化亚铜的熔点为1235℃,其固态时的单晶胞如下图所示。

①氧化亚铜属于__________晶体。
②已知Cu2O的晶胞参数a=425.8pm,则其密度为__________ g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com