
对应反应3S+6KOH=2K2S+K2SO3+3H2O,下列说法正确的是
A.硫是氧化剂,氢氧化钾是还原剂
B.反应中共转移了6个电子
C.还原剂与氧化剂质量比是1:2
D.氧化产物与还原产物分别为K2S和K2SO3
科目:高中化学 来源:2016-2017学年山东省高二12月月考化学卷(解析版) 题型:选择题
常温下,0.1 mol·L-1的某一元酸(HA)溶液中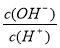 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中水电离出的c(H+)=1×10-11mol•L-1
C.该溶液中水的离子积常数为1×1022
D.用 pH=11的NaOH 溶液 V1 L 与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学卷(解析版) 题型:选择题
在某温度时,将n mol·L-1氨水滴入10mL 1.0mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是:
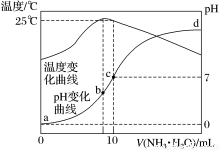
A.a点Kw=1.0×10-14
B.水的电离程度:c > b >a>d
C.b点:c(NH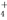 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
D.25℃时,NH4Cl水解常数Kh= 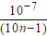 mol·L-1 (用含n的代数式表示)
mol·L-1 (用含n的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上月考二化学卷(解析版) 题型:实验题
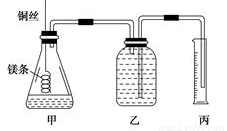
② 配制100mL.1.0mol·L-1的盐酸溶液;
②用__________(填仪器名称并注明规格)量取10.0mL 1.0mol·L-1的盐酸溶液加入锥形瓶甲中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为__________g;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100mL 1.0mol·L-1的盐酸溶液时,下列哪些操作会使配制浓度偏小________(填写字母)。
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
(2)请填写操作步骤中的空格:步骤②_________,步骤③_________g。
(3)实验步骤⑤中应选用____________(填字母)的量筒;
A.100mL B.200mL C.500mL
读数时除恢复到室温,调节乙丙内液面相平外,还要注意 。
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____________L/mol。
(5)若未除去镁条表面的氧化镁,则测得该条件下气体的摩尔体积 (填偏大、偏小或无影响)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上月考二化学卷(解析版) 题型:选择题
将钠、镁、铝各0.3mol分别放入100mL1mol/L的盐酸中,同温同压下产生其他的体积比约是
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上月考二化学卷(解析版) 题型:选择题
下列有关金属的叙述中,正确的是
A.金属元素的单质在常温下都是固体
B.易失电子的物质一定是金属
C.原子核外的最外层只有一个电子的元素一定是金属元素
D.铝是地壳中含量最多的金属元素
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上月考二化学卷(解析版) 题型:选择题
下列化学变化中,需加入氧化剂才能实现的是
A.C→CO2 B.CO2→CO C.CuO→Cu D.H2SO4→BaSO4
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上学期12月月考化学试卷(解析版) 题型:填空题
环境问题已成为全球普遍的热门话题。
(1)氮氧化物是空气的主要污染源之一。可利用甲烷催化还原氮氧化物。已知:
CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH1= -867 kJ·mol-1
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH2= -564 kJ·mol-1
则CH4将NO还原为N2的热化学方程式为 。
(2)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。催化反硝化法中,用H2在催化剂表面将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应的离子方程式为 。

(3)居室装修材料会挥发出甲醛,污染空气。通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的工作原理如图所示,其负极电极反应式为 。
(4)排放到大气中的SO2会形成硫酸型酸雨,SO2形成酸雨的化学方程式为 。燃煤火电发电厂的尾气中含SO2,常用Na2SO3溶液或氨水吸收尾气,生成NaHSO3 或NH4HSO3,已知NaHSO3溶液显酸性,则其溶液中离子浓度大小关系为 。
(5)已知25℃时,Ksp(BaSO4) =1.0 ×10-10mol2·L-2 。现将4.0×10-4mo1/L 的Na2SO4 溶液与一定浓度的BaCl2溶液等体积混合生成沉淀,计算应加入BaCl2溶液的最小浓度为_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:填空题
下表是生活生产中常见的物质,表中列出了它们的一种主要成分(其它成分未列出)
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 天然气 | 白酒 | 醋精 | 苏打 | 小苏打 | 石灰 | 铜线 |
成分 | CH4 | C2H5OH | CH3COOH | Na2 CO3 | NaHCO3 | Ca(OH)2 | Cu |
(1)请你对表中①~⑧的主要成分进行分类(填编号)
在一定条件下能导电的是_________,属于电解质的是_________,属于非电解质的是__________。
(2)写出③除水垢(主要成分为CaCO3)的离子方程式__________________________
写出用⑤治疗胃酸过多的离子方程式为_________________________
用澄清的⑥溶液检验CO2的离子方程式为__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com