
����Ŀ���춡ϩ![]() ��һ����Ҫ�Ļ���ԭ�ϣ������춡��
��һ����Ҫ�Ļ���ԭ�ϣ������춡��![]() ֱ�Ӵ������Ʊ���
ֱ�Ӵ������Ʊ���
(1)��֪��![]()
![]()
д�����춡��![]() �������Ʊ��춡ϩ
�������Ʊ��춡ϩ![]() ���Ȼ�ѧ����ʽ��_________��
���Ȼ�ѧ����ʽ��_________��
(2)һ�������£����춡��Ϊԭ�ϴ����������춡ϩ���¶ȡ�ѹǿ�ĸı���춡��ƽ��ת���ʵ�Ӱ����ͼ��ʾ��

���ж�![]() ��
��![]() �Ĵ�С��ϵ��
�Ĵ�С��ϵ��![]() _____________
_____________![]() (����>������<��)����ʹ��λʱ�����춡ϩ�IJ�����ߣ�����ʹ�춡��ƽ�������ߣ�Ӧ��ȡ�Ĵ�ʩ��____________(����)��
(����>������<��)����ʹ��λʱ�����춡ϩ�IJ�����ߣ�����ʹ�춡��ƽ�������ߣ�Ӧ��ȡ�Ĵ�ʩ��____________(����)��
a�������¶� b�������¶� c������ѹǿ d������ѹǿ �壮ʹ�ô���
��ƽ�ⳣ���ı���ʽ�е�ƽ��Ũ�ȿ�����ƽ��ʱ������ķ�ѹ����(����a�ķ�ѹ=����a�����ʵ�����������ѹǿ����![]() (��)����ͼ�е�A��״̬�µ��춡�����ⷴӦ��ƽ�ⳣ��
(��)����ͼ�е�A��״̬�µ��춡�����ⷴӦ��ƽ�ⳣ��![]() _____________(������λ��Ч����)��
_____________(������λ��Ч����)��
(3)�¶ȶԴ����Ļ��Ժ�Ŀ������ѡ���Զ���һ����Ӱ�졣�±�����![]() Ϊ�������ڷ�Ӧʱ����ͬʱ����õIJ�ͬ�¶��µ����ݡ�
Ϊ�������ڷ�Ӧʱ����ͬʱ����õIJ�ͬ�¶��µ����ݡ�
�¶�/�� | 550 | 570 | 590 | 610 | 630 |
�춡��ת����/% | 13.8 | 24.5 | 25.6 | 30.0 | 33.3 |
�춡ϩѡ����/% | 93.9 | 88.3 | 95.0 | 80.4 | 71.2 |
�춡ϩ�IJ���/% | 12.9 | 21.6 | w | 24.1 | 23.7 |
��֪��ѡ����![]() �����춡��������ѽ����ɶ�̼���������
�����춡��������ѽ����ɶ�̼���������
��590��ʱ�춡ϩ�IJ���![]() _____________��100%��
_____________��100%��
����590��֮ǰ�춡ϩ�IJ������¶����߶������ԭ�������____________��_____________��
��590��֮���춡ϩ���ʽ��͵���Ҫԭ�������_____________��
���𰸡�C4H10(g)=C4H8(g)+H2(g) ��H=+123kJmol-1 > a 0.18 0.243 �����¶ȣ�ƽ�������ƶ� �����¶ȣ���Ӧ���ʼӿ� �춡��������ѽ����ɶ�̼���������и��������ɣ����ʽ��͡�
��������
�������и������Ȼ�ѧ����ʽ���ɸ�˹���ɿ���ã���������ͼʾ��ϵ�����ж�T1��T2��ϵ����ȡ�Ĵ�ʩ�����ݻ�ѧƽ�ⷽ��ʽ��A���ת���ʣ�������ʽ���Kpֵ�������춡���ת���ʺ��춡ϩ��ѡ���ԣ�������춡ϩ�IJ��ʣ��ɻ�ѧƽ�ⷽ��ʽ���������ͼ����Ŀ�ṩ����Ϣ�ж�590��ǰ�������ߵ�ԭ���590���Ժ�����½���ԭ�ݴ˽��
��1���ɢ�C4H10(g)+![]() O2(g)=C4H8(g)+H2O(g)��H1=-119 kJmol-1�͢�H2(g)+
O2(g)=C4H8(g)+H2O(g)��H1=-119 kJmol-1�͢�H2(g)+![]() O2(g)=H2O(g)��H2=-242kJ��mol-1�����ݸ�˹���ɿ�֪����-�ڵõ�C4H10(g)=C4H8(g)+H2(g)������H=��-119kJmol-1��-��-242kJmol-1��=+123kJmol-1����Ϊ��C4H10(g)=C4H8(g)+H2(g)��H=+123kJmol-1��
O2(g)=H2O(g)��H2=-242kJ��mol-1�����ݸ�˹���ɿ�֪����-�ڵõ�C4H10(g)=C4H8(g)+H2(g)������H=��-119kJmol-1��-��-242kJmol-1��=+123kJmol-1����Ϊ��C4H10(g)=C4H8(g)+H2(g)��H=+123kJmol-1��
��2������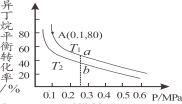 ͼ��֪����������ѹǿ�����������춡���ƽ��ת���ʣ�ȡ��ͬ��ѹǿ�����£���һ��ֱ�߽�T1������a�㣬��T2������b�㣬��a���Ӧ���춡���ƽ��ת����>b���Ӧ���춡���ƽ��ת���ʣ�����C4H10(g)=C4H8(g)+H2(g) +123��H=+123kJmol-1����H>0����Ӧ�����ȵģ������¶ȣ�ƽ��������Ӧ�����ƶ����춡���ƽ��ת���ʲ����������¶�T1>T2����ʹ��λʱ�����춡ϩ�IJ�����ߣ�����ʹ�춡��ƽ�������ߣ����ڸ÷�Ӧ��һ�����ȷ�Ӧ������һ�������������ķ�Ӧ������Ӧ��ȡ�Ĵ�ʩΪ��
ͼ��֪����������ѹǿ�����������춡���ƽ��ת���ʣ�ȡ��ͬ��ѹǿ�����£���һ��ֱ�߽�T1������a�㣬��T2������b�㣬��a���Ӧ���춡���ƽ��ת����>b���Ӧ���춡���ƽ��ת���ʣ�����C4H10(g)=C4H8(g)+H2(g) +123��H=+123kJmol-1����H>0����Ӧ�����ȵģ������¶ȣ�ƽ��������Ӧ�����ƶ����춡���ƽ��ת���ʲ����������¶�T1>T2����ʹ��λʱ�����춡ϩ�IJ�����ߣ�����ʹ�춡��ƽ�������ߣ����ڸ÷�Ӧ��һ�����ȷ�Ӧ������һ�������������ķ�Ӧ������Ӧ��ȡ�Ĵ�ʩΪ��
a�������¶ȣ���������Ӧ���ʣ�����ʹƽ�������ƶ�����a����Ҫ��
b�������¶ȣ���Ӧ���ʼ�С��ƽ�������ƶ�����b������Ҫ��
c������ѹǿ����Ӧ��������ƽ�������ƶ�����c������Ҫ��
d������ѹǿ����Ӧ���ʼ�С��ƽ�������ƶ�������߲��ʣ�����Ӧ���ʼ�С����λʱ�����춡ϩ�IJ�����һ����ߣ���d������Ҫ��
e��ʹ�ô�������ƽ���ƶ���Ӱ�죬��������춡���ƽ��ת���ʣ���e������Ҫ��Ϊ>��a��
��ƽ�ⳣ���ı���ʽ�е�ƽ��Ũ�ȿ�����ƽ��ʱ������ķ�ѹ����(����a�ķ�ѹ=����a�����ʵ�����������ѹǿ����![]() (��)��ͼ�е�A��״̬�£���ѹǿp=0.1MPa���춡���ƽ��ת����Ϊ80%������ʼ״̬C4H10���ʵ���Ϊ1mol�����ݱ仯����=��ʼ������ת���ʿ�֪����ƽ��ʱn(C4H10)=1-1��80%=0.2mol��n(C4H8)=0.8mol��n(H2)=0.8mol,�����ѹΪp(C4H10)=
(��)��ͼ�е�A��״̬�£���ѹǿp=0.1MPa���춡���ƽ��ת����Ϊ80%������ʼ״̬C4H10���ʵ���Ϊ1mol�����ݱ仯����=��ʼ������ת���ʿ�֪����ƽ��ʱn(C4H10)=1-1��80%=0.2mol��n(C4H8)=0.8mol��n(H2)=0.8mol,�����ѹΪp(C4H10)=![]() ��0.1MPa=
��0.1MPa=![]() MPa��p(C4H8)=
MPa��p(C4H8)=![]() ��0.1MPa=
��0.1MPa=![]() MPa��ͬ����p(H2)=
MPa��ͬ����p(H2)=![]() MPa��ƽ�ⳣ��Kp=
MPa��ƽ�ⳣ��Kp= ![]() =
= 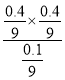 =0.18����Ϊ0.18��
=0.18����Ϊ0.18��
��3���ٸ����춡���ת����=![]() ��100%���춡ϩ��ѡ����=
��100%���춡ϩ��ѡ����=![]() ����C4H10(g)=C4H8(g)+H2(g) +123��H=+123kJmol-1����ʽ��֪�������춡������ʵ����������춡ϩ�����ʵ�����ȵģ����ԣ������춡�����ʼ������춡ϩ�����۲�������������Ŀ����������ĵķ�Ӧ�����������춡ϩ��ʵ�ʲ��������춡ϩ�IJ���=
����C4H10(g)=C4H8(g)+H2(g) +123��H=+123kJmol-1����ʽ��֪�������춡������ʵ����������춡ϩ�����ʵ�����ȵģ����ԣ������춡�����ʼ������춡ϩ�����۲�������������Ŀ����������ĵķ�Ӧ�����������춡ϩ��ʵ�ʲ��������춡ϩ�IJ���= ![]() ��100%����֪��590��ʱ���춡���ת����Ϊ25.6%���춡ϩ��ѡ����Ϊ95%�����춡ϩ�IJ���=25.6%��95%=0.243����Ϊ0.243��
��100%����֪��590��ʱ���춡���ת����Ϊ25.6%���춡ϩ��ѡ����Ϊ95%�����춡ϩ�IJ���=25.6%��95%=0.243����Ϊ0.243��
�ڸ÷�Ӧ�����ȷ�Ӧ�������¶ȣ���Ӧ���ʼӿ죬ƽ�������ƶ�����Ϊ�����¶ȣ�ƽ�������ƶ��������¶ȣ���Ӧ���ʼӿ졣
�۸���590����춡��������ѽ����ɶ�̼���������и��������ɣ������춡ϩ���ʽ��ͣ���Ϊ�춡��������ѽ����ɶ�̼���������и��������ɣ��춡ϩ���ʽ��͡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cu��CuO�Ļ����20.8g���뵽50mL 18.4mol��LŨH2SO4�У����ȳ�ַ�Ӧ������������ȫ�ܽ⣬��ȴ���Һϡ����1000 mL�����c��Cu2+��=0.3 mol��L���Լ��㣺������������̲����֣�
��1����Ӧ�����зų��������ڱ�״���µ��������������������Һ�е��ܽ⣩��______
��2����Һϡ�ͺ�c��H+���Ƕ��٣�__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V1mL1.00mol��L��1HCl��Һ��V2mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ(ʵ����ʼ�ձ���V1��V2=50 mL)������������ȷ���ǣ� ��
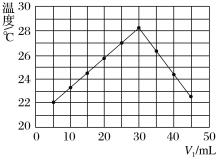
A.��ʵ�������ѧ�ܿ���ת��Ϊ����
B.����ʵ��ʱ�����¶�Ϊ22��
C.NaOH��Һ��Ũ��ԼΪ1.00mol��L��1
D.��ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������㷺Ӧ���ڵ�ơ�����ҽҩ����ҵ�У����кܸߵľ��ü�ֵ��һ���ú����ϴ���(��Ҫ��![]() ��C���������������ĵ��ʼ�������������л���)Ϊԭ���Ʊ�
��C���������������ĵ��ʼ�������������л���)Ϊԭ���Ʊ�![]() �Ĺ����������£�
�Ĺ����������£�

����������������������ʽ����ʱ��![]() ���£�
���£�
������ | ��ʼ����ʱ�� | ��ȫ����ʱ�� |
| 2.7 | 3.2 |
| 7.6 | 9.7 |
| 7.1 | 9.2 |
�ش��������⣺
(1)��Һa�����ʵ���Ҫ�ɷֳ�![]() �⣬������_________________(�ѧʽ)��
�⣬������_________________(�ѧʽ)��
(2)����ǰ��������ȴ���������ҪĿ����____________������b��Ҫ�ɷ���________(�ѧʽ)��
(3)����![]() ��Һʱ������Ӧ�����ӷ���ʽΪ_______����������
��Һʱ������Ӧ�����ӷ���ʽΪ_______����������![]() ���ӵ�ԭ��_______��
���ӵ�ԭ��_______��
(4)����dΪ________�����ˡ�ϴ�ӡ������Ʒ��������ʱ���������![]() ����ԭ�������__________��(д��һ�㼴��)
����ԭ�������__________��(д��һ�㼴��)
(5)ȡag���������Ƶõ�������������Ʒ��������ˮ�У��ڲ��Ͻ����»���������������ͪ���Һ![]() ���ټ���
���ټ���![]() ��Һ������Һ��
��Һ������Һ��![]() ��8~9����ַ�Ӧ���ˡ�ϴ�ӡ���ɡ������õ���ɫ��������Ϊbg��������Ӧ�ķ���ʽΪ
��8~9����ַ�Ӧ���ˡ�ϴ�ӡ���ɡ������õ���ɫ��������Ϊbg��������Ӧ�ķ���ʽΪ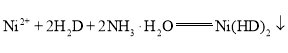 (��ɫ)
(��ɫ)![]() ����֪
����֪![]() ��Է�������ΪM����ʽ������Ʒ����Ϊ_________��
��Է�������ΪM����ʽ������Ʒ����Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��������������õ��Ľ�����ȷ����( )
ѡ�� | ʵ����������� | ���� |
A | �ýྻ�IJ�˿պȡijʳ���������ھƾ��ƻ��������գ������Ի�ɫ | ˵����ʳ���������� |
B |
|
|
C | ��ij��Һ�еμ� | ��Һ�к� |
D | ��ʯ��������ͨ�����ȵ����Ƭ�ֽ�õ�������ͨ��������Ȼ�̼��Һ��������Ȼ�̼��Һ��ɫ | �ֽ�����к���ϩ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������![]() ��һ�ָ�Ч����ȫ������������������һ�ֻ���ɫ���壬11��ʱҺ���ɺ���ɫҺ�壬������ˮ������ˮ��Ӧ����ҵ�������Ŀ�˹͡���Ʊ��������ȵIJ�������ͼ��ͼ1��ij�о�С����ͼ2װ��ģ��
��һ�ָ�Ч����ȫ������������������һ�ֻ���ɫ���壬11��ʱҺ���ɺ���ɫҺ�壬������ˮ������ˮ��Ӧ����ҵ�������Ŀ�˹͡���Ʊ��������ȵIJ�������ͼ��ͼ1��ij�о�С����ͼ2װ��ģ��![]() �������еķ�Ӧ���Ʊ�
�������еķ�Ӧ���Ʊ�![]() (�г�װ������ȥ)
(�г�װ������ȥ)
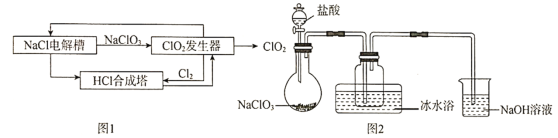
(1)д��![]() �����ᷴӦ�Ļ�ѧ����ʽ��_____________
�����ᷴӦ�Ļ�ѧ����ʽ��_____________
(2)��ˮԡ��������_____________��
(3)![]() ��Һ�з�������Ҫ��Ӧ�����ӷ���ʽΪ_______��
��Һ�з�������Ҫ��Ӧ�����ӷ���ʽΪ_______��
(4)��![]() ͨ�뵽
ͨ�뵽![]() ��Һ�У��������м�������
��Һ�У��������м�������![]() �������ã��۲쵽_________��֤��
�������ã��۲쵽_________��֤��![]() ���������ԡ�
���������ԡ�
(5)![]() ����������ˮ�����������������Լ��ˮ��
����������ˮ�����������������Լ��ˮ��![]() ��Ũ�ȣ��������£�
��Ũ�ȣ��������£�
��ȡ![]() ˮ�������������ĵ⻯�أ���������������Һ�������ԣ������������Һ����Һ����(��֪
ˮ�������������ĵ⻯�أ���������������Һ�������ԣ������������Һ����Һ����(��֪![]() ȫ��ת��Ϊ
ȫ��ת��Ϊ![]() )��
)��
����![]() ��
��![]() ��Һ�ζ�������
��Һ�ζ�������![]() ��Һ
��Һ![]() (��֪��
(��֪��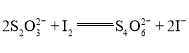 )��
)��
ȷ�������ڴﵽ�ζ��յ��������______�������㣬ˮ����![]() ��Ũ����_________
��Ũ����_________![]() ��
��
(6)һ���¶Ⱥ͵�ѹ�£���⾫��ʳ��ˮ���Ƶ�![]() ��
��![]() ��
��
��֪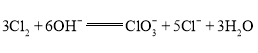 �����ʱӦѡ��___����Ĥ(������������������������)�������缫��ӦʽΪ___��
�����ʱӦѡ��___����Ĥ(������������������������)�������缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�ס����ǵ绯ѧʵ��װ�á�
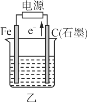
��1�����ס������ձ��о�ʢ��NaCl��Һ��
�ټ���ʯī���ϵĵ缫��ӦʽΪ__________________________________��
�������ܷ�Ӧ�����ӷ���ʽΪ____________________________________��
�۽�ʪ��ĵ���KI��ֽ�������ձ��Ϸ���������ֽ�ȱ�������ɫ��������Ϊ������Cl2���������ɵ�I2������Ӧ��Cl2��I2�����ʵ���֮��Ϊ5��1�������������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ_________��
��2�����ס������ձ��о�ʢ��CuSO4��Һ��
�ټ��������ϵĵ缫��ӦʽΪ__________________________��
�������ʼʱ����ʢ��200 mL pH��5��CuSO4��Һ(25 ��)��һ��ʱ�����Һ��pH��Ϊ1����Ҫʹ��Һ�ָ������ǰ��״̬��������Һ�м���________(��д���ʵĻ�ѧʽ)________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NO2��SO2�������1:2���ں��º����ܱ������з�����Ӧ��NO2(g)��SO2(g)![]() SO3(g)��NO(g) ��H����41.8kJ��mol-1��������˵����Ӧ�ﵽƽ��״̬���ǣ� ��
SO3(g)��NO(g) ��H����41.8kJ��mol-1��������˵����Ӧ�ﵽƽ��״̬���ǣ� ��
A.��ϵѹǿ���ֲ���
B.���������ɫ���ֲ���
C.ÿ����1molSO3��ͬʱ����1molNO
D.NO2��SO2��SO3��NO��Ũ��֮��Ϊ1:1:1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ�з���һ������ˮ﮵�أ�һ�����ø���Ĥ�����Ľ���ﮣ���һ�����������(LiMn2O4)����0.5mol��L-1Li2SO4ˮ��Һ������ʣ���ȫ���ܺͳɱ������е�����ӵ�ض��������Ե����ơ������йظõ�ص�˵������ȷ���ǣ� ��

A.�缫a�Ǹ������缫b������
B.����ʱ��ص��ܷ�ӦΪ��LiMn2O4+Li=Li2Mn2O4
C.�ŵ�ʱ����Һ��Li+��a��bǨ��
D.��طŵ�ʱ��������ӦʽΪ��Li2Mn2O4e-=LiMn2O4+Li+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com