
| A. | 将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可分离出NaCl晶体 | |
| B. | 溶剂蒸发的速度越快,或浓缩后的溶液冷却得越快,析出的晶体颗粒就越大 | |
| C. | 用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| D. | 用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
分析 A.根据物质的溶解度随温度的变化情况来实现物质的分离;
B.溶质的溶解度越小,或溶液的浓度越大,或溶剂的蒸发速度越快,或溶液冷却得越快,析出的晶体颗粒就越小;
C.倾析法用来分离颗粒较大的沉淀,分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离;
D.移液管取液后,应垂直放入稍倾斜的容器中,管尖与容器壁接触,放松食指,使液体自由流出,流完后再等15秒,取出移液管.
解答 解:A.氯化钠的溶解度受温度影响变化不大,氯化钾的溶解度随着温度的升高而升高,可以通过加热冷、却结晶的方法来实现氯化钠和氯化钾的分离,故A正确;
B.晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液的浓度越大,或溶剂的蒸发速度越快,或溶液冷却得越快,析出的晶体颗粒就越小,故B错误;
C.当沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离,分离时,将烧杯静置,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离,故C正确;
D.移液管取液后,将移液管移入准备接受溶液的容器中,使其出口尖端接触器壁,使容器微倾斜,而使移液管直立,然后放松右手食指,使溶液自由地顺壁流下,待溶液停止流出后,一般等待15秒钟拿出,故D正确.
故选B.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、纤维、蔗糖、聚乙烯、淀粉都是高分子化合物 | |
| B. | 研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放 | |
| C. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| D. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:选择题
向盛有饱和碳酸钠溶液的烧杯中,插入惰性电极,接通直流电源,保持温度不变,一定时间后,
溶液中( )
A.Na2CO3浓度减小
B.Na2CO3浓度增大
C.Na2CO3浓度增大,并有晶体析出
D.Na2CO3浓度不变,并有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 加入试剂 | 操作方法 |
| ①苯(苯甲酸) | (2) | (4) |
| ②乙酸乙酯(乙醇) | (5) | (4) |
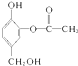 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物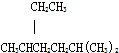 的名称为2-甲基-5-乙基已烷 的名称为2-甲基-5-乙基已烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 化合物 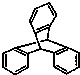 是苯的同系物 是苯的同系物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (2)D和B互为同分异构体,且其苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na和NaOH反应,等质量的D消耗的Na,NaOH的物质的量之比为2:3,请写出两种D的结构简式为
(2)D和B互为同分异构体,且其苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na和NaOH反应,等质量的D消耗的Na,NaOH的物质的量之比为2:3,请写出两种D的结构简式为 或
或
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{+}{C}$H20 | B. | $\stackrel{+}{N}$H3 | C. | $\stackrel{+}{B}$F3 | D. | 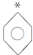 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
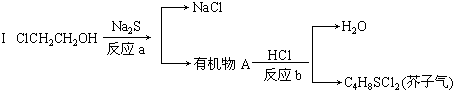

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ②③ | C. | ①② | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com