
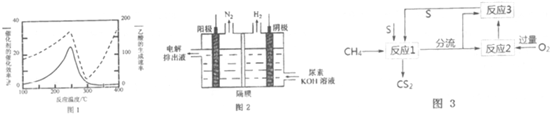
分析 (1)①由图可知,该催化剂在250℃左右时催化剂效率最高;
②先将Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,再根据氧化物与酸反应生成离子方程式,需要注意的是一价铜具有还原性;
③根据图2可知:该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极是阳极,阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水;生成氢气的电极是阴极;
(2)甲烷和硫反应可以制备CS2,其流程:甲烷和硫反应:CH4+4S→CS2+2H2S,分离得到CS2,为了提高CS2产率,设计反应2和3实现硫单质循环利用,
反应2为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,反应3为2H2S+SO2=3S+2H2O.
①根据题干信息反应1产生两种含硫的物质为二硫化碳和硫化氢;
②根据反应3为2H2S+SO2=3S+2H2O分析;
③当反应1中每有1molCS2生成时,反应2中有2molH2S参加反应.
解答 解:(1)①由图可知,该催化剂在250℃左右时催化剂效率最高,温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案:温度超过250℃时,催化剂的催化效率降低;
②Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
③由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成;阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,阴极上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(2)甲烷和硫反应可以制备CS2,反应1:CH4+4S→CS2+2H2S,反应2为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,反应3为2H2S+SO2=3S+2H2O.
①反应1产生两种含硫的物质,可理解为甲烷高温分解生成碳和氢气,碳和硫反应生成二硫化碳、氢气和硫反应生成硫化氢,所以反应1为:CH4+4S→CS2+2H2S,
故答案为:CH4+4S→CS2+2H2S;
②为了提高CS2产率,设计反应2和3实现硫单质循环利用,即通过反应3恰当配比实现硫单质循环利用,反应3为2H2S+SO2=3S+2H2O,所以进入反应2为H2S,反应3的气体为硫化氢燃烧生成的二氧化硫,两者物质的量之比为2:1,
故答案为:2:1;
③反应1:CH4+4S→CS2+2H2S,当反应1中每有1molCS2生成时,反应2中有2molH2S参加反应,2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,需3mol氧气,
故答案为:3mol.
点评 本题考查乙酸、CS2制备,涉及反应条件的分析应用,电解池原理的分析,电极反应书写、硫及其化合物的性质,掌握基础是关键,题目难度中等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
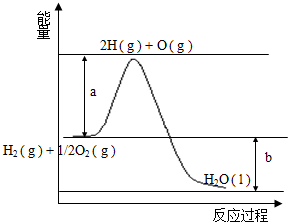 已知H2的燃烧热为285.8kJ•mol-1,反应过程中能量变化如图:请回答下列问题:
已知H2的燃烧热为285.8kJ•mol-1,反应过程中能量变化如图:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ② | B. | ①②④ | C. | ②④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量产品加适量蒸馏水配成稀溶液,滴加足量BaCl2溶液. | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cu2+、Cl-、NO3- | B. | K+、Fe3+、OH-、SCN- | ||
| C. | Ag+、NO3-、Cl-、K+ | D. | Na+、CH3COO-、H+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | Na2HPO4?2Na++HPO42- | ||
| C. | NH4++2H2O?NH3•H2O+H3O+ | D. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com