
| A. | 加入苛性钠溶液 | B. | 用水湿润 | C. | 加少量盐酸 | D. | 加干燥剂使用 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题


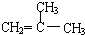 .
.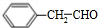 ;F分子中最多有15个原子共面.
;F分子中最多有15个原子共面.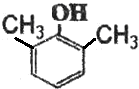 (或
(或 、
、 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
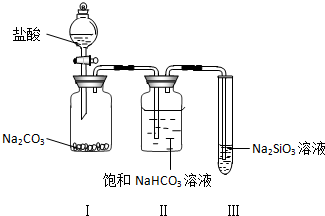
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||||||||
| ⑪ | ⑫ | ||||||||||||||||
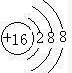 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ③④⑤ | C. | ②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的氯化铁溶液中,若C1-的数目为3 NA,则Fe3+的数目为NA | |
| B. | 1 molN2和3 molH2在一定条件下充分反应,转移电子数目为6NA | |
| C. | 常温下,1L0.1mol/L的Na2S溶液中阴离子数目大于0.1 NA | |
| D. | 0.1 mol Cl2通入水中,转移电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键能越大说明化学键越牢固,所构成的物质越稳定 | |
| B. | 高聚氮晶体属于原子晶体 | |
| C. | 该晶体中氮原子数与氮氮键数比为1:3 | |
| D. | 高聚氮可以用作炸药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com