
 ������Ӧ���ȣ������n��O2����ʱ��ı仯���±�
������Ӧ���ȣ������n��O2����ʱ��ı仯���±�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2(g)��CO2(g)��2H2O(g) ��H��a kJ/mol ���¶�T1��T2ʱ���ֱ�0��50 mol CH4��1��2 mol NO2�������Ϊ1 L���ܱ������У����n(CH4)��ʱ��仯�������±���
N2(g)��CO2(g)��2H2O(g) ��H��a kJ/mol ���¶�T1��T2ʱ���ֱ�0��50 mol CH4��1��2 mol NO2�������Ϊ1 L���ܱ������У����n(CH4)��ʱ��仯�������±���| �¶� | ʱ��/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0��50 | 0��35 | 0��25 | 0��10 | 0��10 |
| T2 | n(CH4) | 0��50 | 0��30 | 0��18 | ���� | 0��15 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)+D(g) ��H<0��ƽ���ƶ�ͼ��Ӱ��ƽ���ƶ���ԭ������� ( )
2C(g)+D(g) ��H<0��ƽ���ƶ�ͼ��Ӱ��ƽ���ƶ���ԭ������� ( )
| A�������¶ȣ�ͬʱ��ѹ |
| B��ѹǿ���䣬�����¶� |
| C��ѹǿ���¶Ȳ��䣬����һЩ��֮����Ӧ�Ķ������� |
| D���¶ȡ�ѹǿ���䣬����һЩA2(g) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)��H2(g)
CO(g)��H2(g) �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO(g)��H2O(g) ��Ӧ�����вⶨ�IJ������ݼ��±�������t2��t1��:
CO(g)��H2O(g) ��Ӧ�����вⶨ�IJ������ݼ��±�������t2��t1��:| ��Ӧʱ��/min | n(CO2)/mol | H2/ mol |
| 0 | 1.50 | 1.00 |
| t1 | | 0.40 |
| t2 | 0.90 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO)]�ı仯����������ͼ��
CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO)]�ı仯����������ͼ��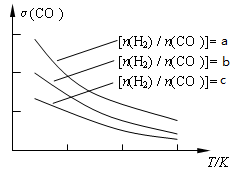
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺
O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺| t/s | 0 | 120 | 180 | 240 | 330 | 30 | 600 | 700 | 800 |
| ��/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
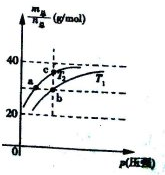
| A��ƽ�ⳣ��K(a)=K(b)<K(c) |
| B����Ӧ���ʣ�va<vb�� |
| C���¶ȣ�T2>T1 |
D����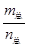 =69g/molʱ����n(NO2)��n(N2O4)=2��1�� =69g/molʱ����n(NO2)��n(N2O4)=2��1�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com