
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
(1)反应Ⅰ的化学平衡常数表达式是K=_______________________________。
(2)一定温度下,在容积可变的密闭容器中进行反应Ⅱ,不能确定上述可逆反应已达到化学平衡状态的是_____________
A.体系的体积不再发生变化 B.生成n mol CO的同时消耗n mol H2O
C.混合气的密度不再改变 D.1 mol H—H键断裂的同时断裂2 mol H—O键
(3)某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同的反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
①对比表中①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因________________________________;
②对比表中①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因___________________________________________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有____________。
a.使用Cu/ZnO纳米棒做催化剂 b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度 d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
(4)反应混合气体经过降温加压可分离出甲醇,剩余气体可再次充入反应器继续反应,经过多次循环往复后混合气体中CO的含量已经很高,可以在另外容器中在合适的催化剂条件下使CO和H2反应合成CH3OH(g),写出该反应的热化学方程式:_______________________________。
【答案】![]() AC 反应Ⅰ为生成甲醇的反应,该反应是放热反应,因此升高温度,平衡逆向进行,因此甲醇的产率减小,甲醇的选择性降低 因为在该时间段内,使用Cu/ZnO纳米片催化剂使反应Ⅰ比反应Ⅱ速率更快,因此测得该时间段内得到的甲醇较多,甲醇选择性提高 cd CO(g)+2H2(g)
AC 反应Ⅰ为生成甲醇的反应,该反应是放热反应,因此升高温度,平衡逆向进行,因此甲醇的产率减小,甲醇的选择性降低 因为在该时间段内,使用Cu/ZnO纳米片催化剂使反应Ⅰ比反应Ⅱ速率更快,因此测得该时间段内得到的甲醇较多,甲醇选择性提高 cd CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-94.9 kJ·mol-1
CH3OH(g) ΔH=-94.9 kJ·mol-1
【解析】
(1) 根据反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)及平衡常数概念书写反应Ⅰ的平衡常数表达式;
CH3OH(g)+H2O(g)及平衡常数概念书写反应Ⅰ的平衡常数表达式;
(2)结合平移状态的特征分析判断;
(3) ①反应Ⅰ是放热反应,根据温度对化学平衡的影响分析;
②使用Cu/ZnO纳米片催化剂使反应I速率增加,该时间内得到的甲醇较多,甲醇选择性提高;
③有利于提高CO2转化为CH3OH平衡转化率,需要使平衡向着正向移动,结合平衡移动原理分析;
(4) 已知:反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1,反应Ⅱ CO2(g)+H2(g)
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1,反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,由盖斯定律可知:反应Ⅰ-反应Ⅱ可得CO(g)+2H2(g)
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,由盖斯定律可知:反应Ⅰ-反应Ⅱ可得CO(g)+2H2(g) ![]() CH3OH(g),由此计算ΔH。
CH3OH(g),由此计算ΔH。
(1) 根据反应ⅠCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)可知,其平衡平衡常数表达式K=
CH3OH(g)+H2O(g)可知,其平衡平衡常数表达式K=![]() ;
;
A.恒压密闭容器中,气体的物质的量越大,体积越大,CO2(g)+H2(g)![]() CO(g)+H2O(g)反应前后气体的总物质的量不发生变化,则容积始终不变,无法说明反应到达平衡,故A错误;
CO(g)+H2O(g)反应前后气体的总物质的量不发生变化,则容积始终不变,无法说明反应到达平衡,故A错误;
B.生成n mol CO的同时消耗n mol H2O,说明正逆反应速率相等,此时反应到达平衡,故B正确;
C.混合气体的质量始终不变,气体的总体积也始终不变,由![]() 可知混合气的密度始终不变,则无法说明反应到达平衡,故C错误;
可知混合气的密度始终不变,则无法说明反应到达平衡,故C错误;
D.1 mol H—H键断裂的同时断裂2 mol H—O键,说明正逆反应速率相等,此时反应到达平衡,故D正确;
故答案为AC;
(3) ①同样催化剂条件下,温度升高,CO2转化率升高,而甲醇的选择性却降低的可能原因:在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低;
②甲醇的选择性却提高的可能原因:因为在该时间内,使用Cu/ZnO纳米片催化剂使反应I速率增加,因此测得该时间内得到的甲醇较多,甲醇选择性提高;
③a.使用Cu/ZnO纳米棒做催化剂,不影响化学平衡,则无法提高CO2转化为CH3OH平衡转化率,故a错误;
b.使用Cu/ZnO纳米片做催化剂,催化剂不影响平衡,无法提高CO2转化为CH3OH平衡转化率,故b错误;
c.该反应为放热反应,降低反应温度,平衡向着正向移动,可提高CO2转化为CH3OH平衡转化率,故c正确;
d.投料比不变,增加反应物氢气的浓度,可提高CO2转化为CH3OH平衡转化率,故d正确;
e.增大CO2和H2的初始投料比,二氧化碳浓度增大,其转化率降低,故e错误;
故答案为:cd;
(4) 已知:反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1,反应Ⅱ CO2(g)+H2(g)
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1,反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,由盖斯定律可知:反应Ⅰ-反应Ⅱ可得CO(g)+2H2(g)
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,由盖斯定律可知:反应Ⅰ-反应Ⅱ可得CO(g)+2H2(g) ![]() CH3OH(g),则ΔH=(-53.7 kJ·mol-1)-(+41.2 kJ·mol-1)=-94.9 kJ·mol-1, 即CO和H2反应合成CH3OH(g)的热化学方程式为CO(g)+2H2(g)
CH3OH(g),则ΔH=(-53.7 kJ·mol-1)-(+41.2 kJ·mol-1)=-94.9 kJ·mol-1, 即CO和H2反应合成CH3OH(g)的热化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-94.9 kJ·mol-1。
CH3OH(g) ΔH=-94.9 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
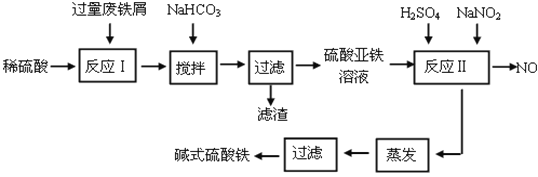
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在_____________________范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为_____________________________________________________________。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为_________________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_________。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 2S2O32-+I2=2I-+S4O62-
则溶液中铁元素的总含量为_________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会_______ (填“偏高” “偏低” “不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生反应:xA(g)+B(g)![]() 2C(g) ΔH<0,A、C的物质的量随时间变化的关系如下表所示。下列有关说法正确的是( )
2C(g) ΔH<0,A、C的物质的量随时间变化的关系如下表所示。下列有关说法正确的是( )
时间/min | n(A)/mol | n(C)/mol |
0 | 0.3 | 0 |
1 | 0.15 | 0.15 |
2 | 0.1 | 0.2 |
3 | 0.1 | 0.2 |
A.x=1
B.反应开始2 min内,用B表示的反应速率为0.05 mol·L-1·min-1
C.反应进行到1 min时,反应体系达到化学平衡状态
D.A的正反应速率等于C的逆反应速率时,反应体系达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示。下列说法正确的是( )
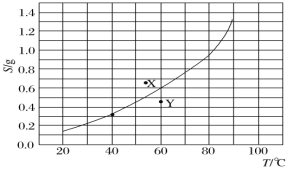
(注:X、Y点是图中所对应的质量的溴酸银放入100克水中,充分溶解后所得到的分散系)
A.溴酸银的溶解是一个熵增、焓减过程
B.对应温度下,X点的分散系中,v(溶解)>v(沉淀)
C.Y点的分散系中,c(Ag+)·c(BrO![]() )>6.25×10-4
)>6.25×10-4
D.60℃时溴酸银饱和溶液中c(BrO![]() )≈0.025mol·L-1
)≈0.025mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的说法正确的是
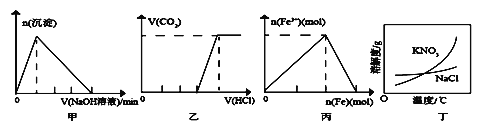
A. 图甲表示:向某明矾溶液中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量,生成气体的体积与滴加HCl溶液体积的关系
C. 图丙表示:在稀硝酸溶液中逐渐加入铁粉至过量,溶液中Fe3+物质的量与逐渐加入铁粉物质的量的变化关系
D. 除去混在硝酸钾中少量的氯化钠可用“蒸发浓缩、趁热过滤”的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳在空气中燃烧后所得4.48 L(标准状况)的混合气体,组成为CO、CO2、N2(其他成分忽略),平均相对分子质量为30,与足量的灼热氧化铜反应,所得的气体质量增加了0.4 g:
(1)N2的体积________。
(2)原空气中O2、N2的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH+2H2O![]() Zn(OH)42-。下列说法不正确的是( )
Zn(OH)42-。下列说法不正确的是( )
A. 充电时,电解质溶液中K+向阴极移动
B. 充电时,电解质溶液中c(OH)逐渐增大
C. 放电时,负极反应为:Zn+4OH2e=Zn(OH)42-
D. 放电时,电路中通过2 mol电子,消耗氧气11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4[Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mgkgˉ1。一种制备黄血盐的工艺如下:
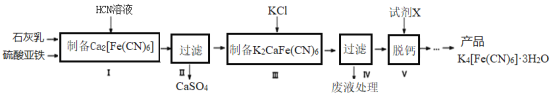
回答下列问题:
(1)步骤Ⅰ反应的化学方程式为____________。
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为(填化学式)___________________。
(3)步骤Ⅴ所用的试剂X是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,可逆反应mA(g) + nB(g)![]() pC(g)的化学平衡常数为K,下列说法正确的是
pC(g)的化学平衡常数为K,下列说法正确的是
A. 其他条件不变,升高温度,K 值一定增大
B. 其他条件不变,增大B(g)的浓度,K值增大
C. 其他条件不变,增大压强,K值不变
D. K值不会随反应条件的改变而改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com