
(8分)已知下列氧化还原反应在溶液中均能发生。
①2Fe3++2I-=2Fe2++I2;②2Fe2++Br2=2Fe3++2Br-;③2Br-+Cl2=2Cl-+Br2。
(1)Fe2+、Br-、I-三种微粒按还原性由强到弱的顺序为____________________。
(2)现有某混合溶液中含a mol FeI2和b mol FeBr2,向该混合液中逐渐通入c mol Cl2,试根据以上化学原理分析,当只有I-被氧化时,c的取值范围是______________。
(3)某混合溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为_____________________。
(1)I->Fe2+>Br-(2分) (2)0<c≤a(3分) (3) 7∶3(3分)
【解析】
试题分析:要准确的判断下述三个氧化还原反应中的氧化剂和还原剂以及氧化产物和还原产物
2Fe3++2I-=2Fe2++I2;2Fe2++Br2=2Fe3++2Br-;2Br-+ Cl2=2Cl-+Br2,还原剂的还原性强于还原产物,I->Fe2+>Br->Cl-,因此Fe2+、Br-、I-三种微粒按还原性由强到弱的顺序为I->Fe2+>Br-;混合溶液中含a mol FeI2和b mol FeBr2,向该混合液中逐渐通入c mol Cl2,当只有I-被氧化时,本题考查氧化还原反应的“反应先后规律”,当同一氧化剂遇到多种还原剂时,先和还原性强的先反应,根据I->Fe2+>Br->Cl-的顺序,那么只有I-被氧化时,即只发生2I-+ Cl2= I2 + 2 Cl-的反应,a mol FeI2 中含有2a mol I-,根据方程式的计量关系2I-— Cl2,最多需要a mol Cl2,当只有I-被氧化时,c的取值范围是0<c≤a;某混合溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1, 依据题意,设ICl-、Br-、I-的物质的量分别为2mol、3mol、4mol,由“电荷”守恒可得:2n(Fe2+)= n(Cl-)+n(Br-)+n(I-)= 2mol + 3mol + 4mol = 9mol,n(Fe2+)=4.5mol,通入氯气后,要满足 n(Cl-)︰ n(Br-)=3︰1,因为Cl-、Br-的物质的量为2mol、3mol,Cl-只要增加7mol就可以,即n(Cl-)︰ n(Br-)=9︰3,增加7mol Cl-即需通入氯气3.5mol.4mol I- 先消耗2mol氯气,余1.5mol氯气消耗3mol Fe2+,剩余Fe2+1.5mol(4.5mol-3mol),则通入氯气与剩余Fe2+的物质的量之比为:3.5︰1.5=7︰3 。
考点:氧化还原反应 氧化还原反应的规律 化学计算
点评:本题重点考察氧化还原反应的规律与计算,重点掌握氧化还原反应的“性质强弱规律”与“反应先后规律”,第(3)问,可采用具体赋值的办法,结合上述规律更加容易解题。


科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:选择题
硝基苯中溶有少量CaCl2,适宜的提纯方法是
A.过滤 B.蒸馏 C.分液 D.纸上层析
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:选择题
丙酮(CH3COCH3)在某溶剂里,在催化剂作用下发生反应: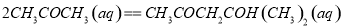 取相同浓度的
取相同浓度的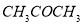 ,分别在40℃和60℃时,测得其转化率
,分别在40℃和60℃时,测得其转化率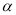 随时间变化的关系曲线(
随时间变化的关系曲线(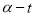 )如图所示。下列说法正确的是
)如图所示。下列说法正确的是
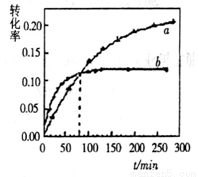
A.b代表40℃时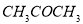 的
的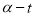 曲线
曲线
B.升高温度可缩短该反应达平衡的时间并能提高平衡转化率
C.增大压强可缩短该反应达平衡的时间并能提高平衡转化率
D.上述反应的逆反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
11.室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是

A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
4.下列电离方程式中正确的是
A.NaHCO3溶于水:NaHCO3=Na++H++CO32-
B.NaHSO4熔化:NaHSO4=Na++H++SO42-
C.HF溶于少量水中:2HF H++HF2一
H++HF2一
D.(NH4)2 SO4溶于水:(NH4)2 SO4=2NH4++SO42一
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列示意图与对应的反应情况正确的是
A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2
B.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
C.NaHSO4溶液中逐滴加入Ba(OH)2溶液
D.NaAlO2溶液中逐滴加入稀盐酸
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温、常压下,16 g O3中含有的氧原子数为
B.7.8 g Na2O2与水充分反应,转移的电子数为0.2 NA
C.0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.3NA
D.标准状况下,11.2 L H2O中含有的氢原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三“一诊”理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.将0.1 molFeCL3溶液于1 L水中,所得溶液含Fe3+离子数目为0.1 NA
B.1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA
C.常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA
D.在高温下,有1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法正确的是
A.微粒半径:Z2+>W2->R-
B.对应氢化物的稳定性:W>R
C.W与X、W与Z形成的化合物晶体类型相同
D.Y的最高价氧化物对应的水化物是弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com