
����Ŀ����һ��ij��Һ�п��ܺ���Fe2����Mg2����Cu2����NH4����Al3���е�һ�ֻ��֡�������һ�ֵ���ɫ���岢������Һʱ���д̼�������ų��Ͱ�ɫ�������ɣ����뵭��ɫ��������ʵ����������꣩�����������Ͳ�����������ʵ����������꣩�Ĺ�ϵ������ͼ1��ʾ������д���пհף�
��1���ڸ���Һ�к��е�������_____________�����ʵ���Ũ��֮��Ϊ_______________��
��2�����ӵĵ���ɫ������________________����ѧʽ����

������������ʯ����Ҫ�ɷ�ΪFeS2������FeS���������������в���Fe��SԪ�أ��Ҹ����²�������ѧ�仯�������ҹ���������᳧��ȡ�������Ҫԭ�ϡ�ij��ѧ��ȤС��Ըû�����ʯ��������ʵ��̽������m1 g�û�����ʯ����Ʒ������ͼ2װ�ã��гֺͼ���װ���ԣ���ʯӢ���У���a�����ϵػ���ͨ��������������ջ�������Ʒ����Ӧ��ȫ���䷴Ӧ�Ļ�ѧ����ʽΪ��![]()
��ʵ��һ�����ⶨ��Ԫ�صĺ���
��Ӧ��������ƿ�е���Һ�������´�����

��3����Ӧ��������ƿ�е���Һ�������H2O2��Һ��Ŀ���ǣ��û�ѧ����ʽ��ʾ��________________________________________��
��4���û�����ʯ����Ԫ�ص���������Ϊ______________���г�����ʽ���ɣ���
��ʵ��������ⶨ��Ԫ�صĺ���

��5�����У���Ҫ�õ����������ձ�������������ͷ�ι��⣬����_________________��
��6��ijͬѧһ�����������εζ�ʵ�飬ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ |
����KMnO4��Һ���/mL | 25.00 | 25.03 | 24.97 |
�����������ݣ������ϡ��Һ��Fe2+�����ʵ���Ũ��Ϊc(Fe2+) ��_______________��
���𰸡� Mg2����Al3����NH4�� 1��1��3 Na2O2 Na2SO3+H2O2=Na2SO4+H2O 32m2/233m1��100% 250mL����ƿ 0.5mol/L
����������һ������ɫ���������Һ�У���������Һʱ���д̼�������ų��Ͱ�ɫ�������ɣ���ɫ����ΪNa2O2��ͼ��ʵ��Ϊ����ͼ����һ�������һ�����������壬�����һ�������dz�����ͼ���м���8mol�������ƺ�����С����û����ȫ�ܽ⣬����Һ��һ��û��Fe2����Cu2����һ����NH4����Al3����Mg2��������8mol��������֮�����������С���ʼ���8mol��������ʱ��笠�������ȫ��Ӧ��
��1���ڸ���Һ�к��е������� Mg2����Al3����NH4�� ; ���������֪��n��Mg2����=n[Mg��OH��2]=2mol��n��Al3����=4mol-n[Mg(OH)2]=2mol����n��Na2O2��=8molʱ����2Na2O2+2H2O=4NaOH+O2������֪n��O2��=8mol��1/2=4mol������n��NH4����=n��NH3��=10mol-n��O2��=6mol����n��Mg2������n��Al3������n��NH4����=2mol��2mol��6mol=1��1��3; (2)����ɫ����ΪNa2O2��
��������3����Ӧ��������ƿ�е���Һ�������H2O2��Һ��Ŀ���ǣ�Ϊʹ�������������ȫת��Ϊ��������ӣ������˫��ˮҪ�����������ķ�Ӧ�Ļ�ѧ����ʽΪ��Na2SO3+H2O2=Na2SO4+H2O��
(4)�������ó��������ᱵ��������ԭ���غ��������������������Ϊx��
S������BaSO4
32g 233g
x m2g
x=32m 2/233g
��������=![]()
��5��������У�һ�����ʵ���Ũ����Һ�������У������ձ�������������ͷ�ι��⣬����Ҫ250mL����ƿ��
��6��������ζ������и��������Һƽ���������=![]() =25mL��
=25mL��
������ԭ��ӦΪ��5Fe2��+MnO4��+8H��=Mn2��+5Fe3��+4H2O���������������ʵ���Ϊn����
5Fe2��+MnO4��+8H��=Mn2��+5Fe3��+4H2O
5 1
n 0.1mol��L��1��0.025L
n=0.0125mol��
c��Fe2����=![]() =0.5000mol��L��1��
=0.5000mol��L��1��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ʽ�����뷽��ʽ�����ӷ���ʽ���Ƿdz���Ҫ�Ļ�ѧ���
��1�����³�ѹ��,��������ʮ������:
��Al��NaHSO4���Ҵ���CO2�ݴ����С�մ��Fe(OH)3��NaOH�ᰱˮ��(NH4)2SO4
����״̬�¿ɵ����������______________(���ţ���ͬ);���ڷǵ���ʵ���______________����������ʵ���________;����ˮ�еĵ��뷽��ʽΪ________��
��2������ʮ��������������������ˮ��Һ�пɷ�����Ӧ�����ӷ���ʽΪ:H++OH-=H2O,�÷�Ӧ�Ļ�ѧ����ʽΪ__________��
��3���������ƿ���Ϊ������ߺ�DZˮͧ�еĹ�������д�����������������̼��Ӧ�Ļ�ѧ����ʽ____________��
��4����д��ʵ�����Ʊ�Fe(OH)3��������ӷ���ʽ___________��
��5����֪PbSO4������ˮ���������ڴ������Һ,��Ӧ����ʽ����:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4���ֽ�Na2S��Һ�����Ǧ��Һ����г������ɣ����䷴Ӧ�����ӷ���ʽӦΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ�� ��Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g����H1=��26.7kJmol��1
��3Fe2O3��s��+CO��g���T2Fe3O4��s��+CO2��g����H2=��50.75kJmol��1
��Fe3O4��s��+CO��g���T3FeO��s��+CO2��g����H3=��36.5kJmol��1
��ӦFeO��s��+CO��g���TFe��s��+CO2��g�����ʱ�Ϊ�� ��
A.+7.28 kJmol��1
B.��7.28 kJmol��1
C.+43.68 kJmol��1
D.��43.68 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���Բ;��У�Ŀǰ����з�չǰ�����ǣ��� ��
A. ���۲;�B. ֽľ�;�C. ���ϲ;�D. �����;�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ�����еij���������CΪ���Ժ�ɫ���壬A��B��C��D֮��ת����ϵ

��1��д���������ʵĻ�ѧʽB_____________��C____________��
��2��C+�����B+D�����ӷ���ʽΪ__________________________________��D����Һ����Ϊӡˢ��·�塰��ʴҺ����д���÷�Ӧ�Ļ�ѧ����ʽ__________________________��
��3��ʵ���ұ���B����Һʱ����������A��ԭ����_________________�������ӷ���ʽ��ʾ��
��4����B��Һ�еμ�NaOH��Һ��������������___________________________����������������������ԭ��Ӧ�Ļ�ѧ����ʽ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£�ijͬѧ��100mL H2S������Һ��ͨ��SO2 �� ������ҺpH�仯��ͼ��ʾ�����з�������ȷ���ǣ� �� 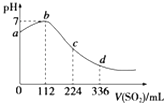
A.b���Ӧ����Һ��������ǿ
B.�������DZ��������������
C.ab�η�Ӧ��SO2+2H2S�T3S��+2H2O
D.ԭH2S��Һ�����ʵ���Ũ��Ϊ0.05molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��ԭ��L���������K���������5������Ԫ�ص���������ϼ�Ϊ�� ��
A. +5B. +6C. +7D. ����������ϼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������ת��

�Իش�(1)д��B�Ļ�ѧʽ ��D�Ļ�ѧʽ ��
(2)д����Eת���F�Ļ�ѧ����ʽ ��
(3)д����KSCN����G��Һ��ʵ�������� ����G��Һ����A���й����ӷ�Ӧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����27.2gCuO��Cu�Ļ�����м���ijŨ�ȵ�ϡHNO3500mL��������ȫ�ܽ������NO��Cu��NO3��2 �� ��������Һ�м���1mol/L ��NaOH��Һ1Lʹ��������ǡ����ȫ��������ʱ��Һ�����ԣ����ó�������Ϊ39.2g����
��1��Cu��Cu2O �����ʵ���֮��Ϊ ��
��2��HNO3�����ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com