
【题目】氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_________________________。
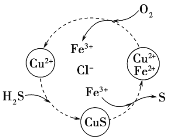
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。该图示的总反应为_________________________。
(3)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。
___Al+___NO3-+___ =___AlO2-+___N2↑+___H2O
【答案】Cl2+2OH-=Cl-+ClO-+H2O 2H2S+O2=2S↓+2H2O 10 6 4OH- 10 3 2
【解析】
(1)氯气与氢氧化钠反应生成NaCl和NaClO;
(2)由图可知,Cu、H、Cl元素的化合价不变,Fe、O、S元素的化合价变化,总反应为硫化氢与氧气的反应,生成S和水;
(3)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,结合电荷守恒、原子守恒配平其它物质的系数。
(1)氯气与氢氧化钠反应生成NaCl和NaClO,反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O;
(2)根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,总反应方程式为2H2S+O2=2S↓+2H2O;
(3)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知硝酸根系数为6,由Al元素守恒可知偏铝酸根系数为10,由电荷守恒可知氢氧根系数为4,由H元素守恒可知水的系数为2,故配平后离子方程式为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】关于右图所示装置(海水为弱碱性)的说法错误的是

A. 若d为石墨,则铁片上的电子反应为:Fe —2e → Fe2+
B. 若d为铜片,则铁片腐蚀加快
C. 若d为锌片,则铁片上的电极反应为:2H+ +2e → H2↑
D. 若d为锌片,则这种保护铁片的方法属于牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种免疫调节剂,其结构简式如图所示,关于该物质的说法不正确的是
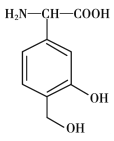
A. 属于芳香族化合物,分子式为C9H11O4N
B. 可以发生的反应类型有:加成反应、取代反应、氧化反应、聚合反应
C. 分子中所有碳原子有可能在同一平面上
D. 1mol该调节剂最多可以与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①标准状况下,2.24 L水中含有0.1 NA个水分子
②常温常压下,32g SO2 含有的分子数为0.5NA
③2 mol NaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤2mol/L的CaCl2溶液中Cl-的数目为4NA
⑥常温常压下,1mol氦气含有的原子数为NA
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2015年11月首架C919打飞机总装下线,标志着我国跻身飞机研制先进国家行列。
①机身蒙皮使用的是第三代铝锂合金材料。下列不属于铝锂合金性质的是___(填字母)。
a.密度大 b.硬度大 c.抗腐蚀
②飞机轮胎属于橡胶制品。下列材料可用来合成橡胶的是____(填字母)。
a.石英砂 b.石灰石 c.异戊二烯
③机体先进复合材料的使用率达12%。下列属于复合材料的是___(填字母)。
a.钛合金 b.玻璃钢 c.普通陶瓷
(2)秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:

①属于人体所需微量元素的是____。
②属于水溶性维生素的是____,属于糖类的有阿拉伯果糖、___。
③蛋白质在人体内最终的水解产物是_____。
(3)化学能帮助我们更好地认识生活、改善生活。
①家用铁锅未洗净晾干,放置一段时间后出现红褐色锈斑,其主要的原因是铁发生了____腐蚀。
②乘车禁止携带物品的部分标识如图所示。在浓硝酸、食盐、汽油、石膏四种物品中,不能携带上车的是_____。

③过氧乙酸(![]() )易分解为乙酸和氧气,其稀溶常用于餐具、器械的消毒。写出过氧乙酸分解的化学方程式______。某胃药的主要成分是AlbMgc(OH)mCO3,常用于治疗胃酸过多,写出其中与胃酸反应的化学方程式_______。
)易分解为乙酸和氧气,其稀溶常用于餐具、器械的消毒。写出过氧乙酸分解的化学方程式______。某胃药的主要成分是AlbMgc(OH)mCO3,常用于治疗胃酸过多,写出其中与胃酸反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某化学实验小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,某同学设计了如图所示的实验装置(氯气易溶于CCl4,HCl不溶于CCl4)。
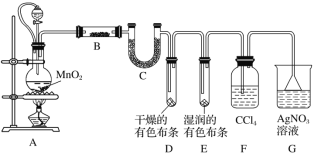
请回答下列问题:
(1)装置A中连接橡皮管的目的是_____________________________________。
(2)装置A中发生反应的离子方程式为_________________________________,装置B中盛放的试剂是___________。
(3)装置D与E中出现的不同现象说明的问题是_________________________。
(4)有同学基于实验的严谨性考虑,认为可在F、G两个装置之间再加一个装有湿润的淀粉KI试纸的装置,其目的是___________________________________。
Ⅱ.某研究性学习小组欲制备漂白粉,设计在上述装置A后连接如右图所示的组合装置:
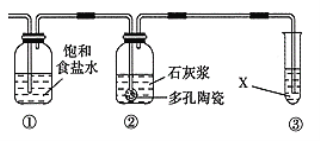
(5)装置②中发生反应的化学方程为___________________________________。
(6)制漂白粉的反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用下列装置和操作,能达到实验目的的是

A. 用装置甲分离出溴苯 B. 用装置乙验证乙炔的还原性
C. 用装置丙制取乙烯 D. 用装置丁制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为_______________;
(2)Y元素原子的价层电子的轨道表示式为_____________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物沸点高低______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中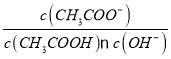 不变
不变
B.溶液中导电粒子的数目减少
C.醋酸的电离程度增大,c(H+)亦增大
D.完全致中和醋酸需加入10mLpH=11的NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com