
已知25℃、100 kPa条件下:
4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2 834.9 kJ·mol-1
4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3 119.1 kJ·mol-1
由此得出的正确结论是( )
A.等质量的O2比O3能量低,由O2变为O3为吸热反应
B.等质量的O2比O3能量低,由O2变为O3为放热反应
C.O3比O2稳定,由O2变为O3为吸热反应
D.O2比O3稳定,由O2变为O3为放热反应
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
据调查,劣质的家庭装饰材料会释放出百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同大小的小球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该有机物的叙述错误的是( )
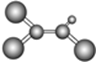 A.有机物化学式为C2HCl3
A.有机物化学式为C2HCl3
B.分子中所有原子在同一平面内
C.该有机物难溶于水
D.可由乙炔和氯化氢加成得到
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.能使pH试纸呈红色的溶液中可能大量存在以下离子:Na+、NH4+、I一、NO3-
B.将CH3 COOH溶液和NaOH溶液等体积混合,该溶液中一定存在的关系式为:
c( Na+)=c(CH3 COO一)+c(CH3COOH)
C.pH =3的NaHA溶液中粒子浓度大小为:
c( Na+)>c( HA一)>c(A2一)>c(H2A)>c(OH一)
D.CuSO4溶液遇到闪锌矿(ZnS)慢慢转化为铜蓝(CuS),是因为ZnS的溶解度大于CuS
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2O(g)===H2O(l) ΔH=Q1 kJ·mol-1
C2H5OH(g)===C2H5OH(l) ΔH=Q2 kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=Q3 kJ·mol-1
若使46 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.(Q1+Q2+Q3) kJ B.0.5(Q1+Q2+Q3) kJ
C.(0.5Q1-1.5Q2+0.5Q3) kJ D.-(3Q1-Q2+Q3) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O===O | P===O |
| 键能/kJ·mol-1 | 172 | 335 | 498 | X |
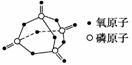
已知白磷的燃烧热为-2 378.0 kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=____________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:
C(石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1③
则由C(石墨)和H2(g)反应生成1 mol C2H2(g)的焓变为____________。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量。已知单质碳的燃烧热为y kJ·mol-1,则1 mol C与O2反应生成CO的反应热ΔH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L-1的CuCl2溶液,B池中加入0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( )

A.2∶2∶4∶1 B.1∶1∶2∶1 C.2∶1∶1∶1 D.2∶1∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
要做到平衡膳食,需遵循的原则是 ( )。
①品种多样化 ②各类食物比例适当 ③每餐摄入的量要适当 ④食物之间要调配得当、烹调合理
A.①②③④ B.①②④
C.②③④ D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com