
【题目】补铁剂常用于防治缺铁性贫血,其有效成分般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。回答下列问题:
(1)能表示能量最低的亚铁离子的电子排布式是__(填标号)。
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
(2)琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是__,碳原子的杂化方式是__;琥珀酸亚铁中存在配位键,在该配位键中配位原子是__,中心原子是__。
(3)富马酸和马来酸互为顺反异构体,其电离常数如下表:
物质名称 | Ka1 | Ka2 |
富马酸( | 7.94×10-4 | 2.51×10-5 |
马来酸( | 1.23×10-2 | 4.68×10-7 |
请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:__。
(4)β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a=870pm、b=680pm、c=479pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。在该晶胞中,硫酸根离子在空间上有__种空间取向,晶胞体内硫酸根离子的个数是__,铁原子周围最近的氧原子的个数为__;设阿伏加德罗常数的值为NA,则该晶体的密度是__g·cm-3(列出计算表达式)。
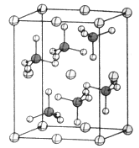
【答案】d 氧原子 sp2、sp3 氧原子 铁原子 马来酸中存在分子内氢键,提高了羧基的离子性,有利于酸性电离,因此马来酸电离主要以第一步电离为主 2 2 6 ![]()
【解析】
(1)基态铁原子核外电子排布式为[Ar]3d64s2,失去2个电子后变为亚铁离子,基态亚铁离子核外电子排布式为[Ar]3d6,因此能表示能量最低的亚铁离子的电子排布式是d;
(2)H、C、O中H元素电负性最小,C、O为同周期元素,原子序数越大,电负性越大,因此电负性最大的是O;C原子连接4个原子形成共价键时,C原子采用sp3杂化,C原子连接3个原子形成共价键时,C原子采用sp2杂化,因此丁二酸中碳原子的杂化方式为sp2、sp3;丁二酸中只有氧原子上有孤电子对,亚铁离子中存在空轨道,因此琥珀酸亚铁的配位键中配位原子为氧原子,中心原子为铁原子;
(3)马来酸中存在分子内氢键,提高了羧基的离子性,有利于酸性电离,因此一级电离较为容易,而剩余部分因为形成了分子内氢键而很稳定,相对难以电离,因此马来酸电离主要以第一步电离为主;
(4)该晶胞中,硫酸根离子在空间上的取向有: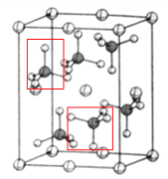 ,一共2种;β-硫酸亚铁的化学式为FeSO4,晶胞中含有亚铁离子数目为
,一共2种;β-硫酸亚铁的化学式为FeSO4,晶胞中含有亚铁离子数目为![]() ,则晶胞中所含硫酸根离子数目为4,从晶胞示意图中可以发现有6个硫酸根离子,其中有4个位于面上,故晶胞体内有2个硫酸根离子;以体心的亚铁离子为研究对象,每个硫酸根中均有一个氧原子离铁原子最近,亚铁离子周围最近的氧原子的个数为6;该晶体的密度
,则晶胞中所含硫酸根离子数目为4,从晶胞示意图中可以发现有6个硫酸根离子,其中有4个位于面上,故晶胞体内有2个硫酸根离子;以体心的亚铁离子为研究对象,每个硫酸根中均有一个氧原子离铁原子最近,亚铁离子周围最近的氧原子的个数为6;该晶体的密度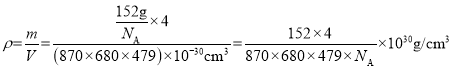 。
。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—E为常见的有机物。以A为原料合成化合物E,其合成路线如图1所示。已知:A的产量通常用来衡量一个国家的石油化工水平;2CH3CHO+O2![]() 2CH3COOH。
2CH3COOH。
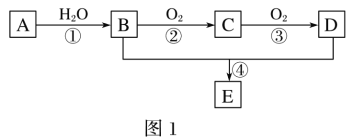
(1)A的分子式______。
(2)A中官能团的名称是_____;B中官能团的结构简式是_____。
(3)反应①的反应类型为_____;反应④的反应类型为_____。
(4)反应④的化学方程式为_____。
(5)某学习小组设计B催化氧化的实验装置如图,根据图2装置回答问题。
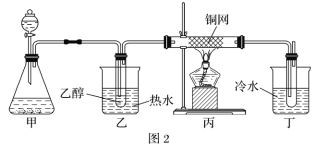
①装置甲锥形瓶中盛放的固体为过氧化钠,请写出甲中反应的化学方程式_____。
②B催化氧化的产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为_____。
③实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.化学反应的实质是旧键的断裂,新键的生成
B.CH4、CF4、CCl4、CBr4 熔、沸点逐渐升高,原因是分子间作用力逐渐增大
C.NH3 和 H2O 分子间都可以形成氢键
D.NH4H 是离子化合物,其含有离子键、极性键、非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。如图是以硫酸氧钛为原料制备纳米二氧化钛的工艺流程图:
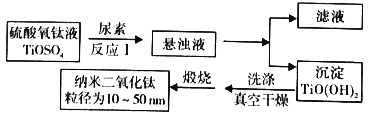
回答下列问题:
(1)反应1中发生两个反应,其一是尿素[CO(NH2)2]与H2O反应生成CO2和NH3·H2O,则另一反应的离子方程式为__。
(2)判断TiO(OH)2沉淀是否洗净的实验操作和现象是:__。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过__、__、__(填基本操作)即可回收__(填化学式)。
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米二氧化钛产率的影响,设计如下实验。
实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比n[CO(NH2)2]:n[TiO(OH)2] |
① | 90 | 1 | 2:1 |
② | 90 | 2 | 3:1 |
③ | 90 | 1 | |
④ | 110 | 2 | 3:1 |
实验②和④的实验目的是__,实验③中反应物物质的量配比为__。
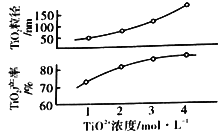
(5)反应Ⅰ中TiO2+浓度对TiO2的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的TiO2+浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂,常温下为橙黄色固体,熔点:38.3℃,沸点233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2 +C+ 2Br2 ![]() TiBr4+CO2来制备TiBr4,装置如图所示。下列说法错误的是
TiBr4+CO2来制备TiBr4,装置如图所示。下列说法错误的是
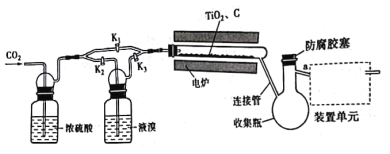
A.开始反应时,活塞的状态为K1关闭,K2,K3打开
B.为防止连接管堵塞,反应过程中需微热连接管
C.为达到实验目的,a应连接盛有NaOH溶液的洗气装置
D.反应结束后继续通入CO2排出装置中残留的四溴化钛及溴蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
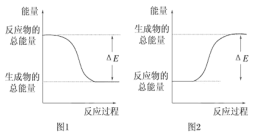
【题目】(一)下列反应中,能量变化符合图 1 的有____ (填序号,下同),符合图 2 的有______。
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤碳与二氧化碳高温反应 ⑥食物因氧化而腐败
(二)为了探究化学能与热能的转化,某实验小组设计了如下图(I、II、III)三套实验装置:
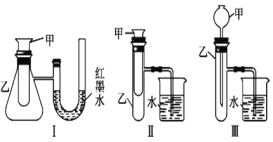
(1)某同学选用装置I进行实验(实验前 U 形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U 形管中可观察到的现象是________。
(2)为探究固体 M 溶于水的热效应,选择装置II进行实验(反应在甲中进行)。
①观察到烧杯里产生气泡,则可推出 M 溶于水___是放热反应(填“一定”或“可能” ),理由是_______;
②若观察到烧杯里的玻璃管内形成一段水柱,则 M 可能是____________。
(3)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置____(填 “I”或“III”)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
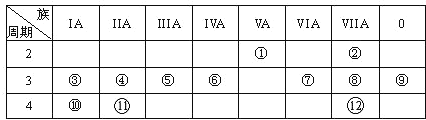
(1)写出下列元素符号:①______ ,⑥______,⑦______。
(2)画出原子的结构示意图:④________________,⑧_________________。
(3)在①~![]() 元素中,金属性最强的元素是_____,非金属性最强的元素是______,最不活泼的元素是_______(均填元素名称)。
元素中,金属性最强的元素是_____,非金属性最强的元素是______,最不活泼的元素是_______(均填元素名称)。
(4)元素③、⑩、![]() 的氢氧化物碱性由强到弱的顺序________________;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序______________________(均用化学式填空)。
的氢氧化物碱性由强到弱的顺序________________;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序______________________(均用化学式填空)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )
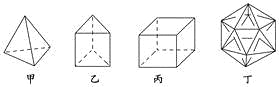
A. 1 mol甲分子内含有10 mol共价键
B. 由乙分子构成的物质不能发生氧化反应
C. 丙分子的二氯取代产物只有三种
D. 分子丁是不可能合成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com