
【题目】H2A为二元弱酸。20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100molL﹣1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )

A. H2A的Ka1=10﹣1.2
B. pH=4.2的溶液中:c(HA﹣)=c(A2﹣)=0.050 molL﹣1
C. pH=7的溶液中:c(Na+)>2c(A2﹣)+c(H+)
D. c(Na+)=0.150 molL﹣1的溶液中:2c(OH﹣)+c(HA﹣)+3c(H2A)=2c(H+)+c(A2﹣)
【答案】AC
【解析】
A. 根据H2A的第一步电离平衡常数Ka1 = ![]() 作答;
作答;
B. 溶液中存在微弱的电离与水解,c(H2A) ![]() 0;
0;
C. 结合H2A的第二步电离平衡常数Ka2及电荷守恒规律分析作答;
D. 根据电荷守恒与物料守恒作答。
A. 从图中可看出,当pH = 1.2时,c(H2A) = c(HA-),则H2A的Ka1=![]() = 10-pH = 10-1.2,故A项正确;
= 10-pH = 10-1.2,故A项正确;
B. 从图中可看出,在pH=4.2的溶液中:c(HA-)=c(A2-),因有少许H2A图中未显示,结合题设条件c(H2A)+c(HA-)+c(A2-)=0.100 mol·L-1,则c(HA-)等于c(A2-)略小于0.050 mol/L,故B项错误;
C.其中在pH=4.2时,可计算出二元弱酸H2A的第二步电离平衡常数 = ![]() = 10-4.2在pH=7的溶液c(A2-)接近0.1 mol/L,c(H+)=10-7 mol/L,带入上述平衡常数表达式可得c(HA-) = 10-3.8> c(H+),根据电荷守恒规律又知c(Na+)=2c(A2-)+c(HA-),则c(Na+)>2c(A2-)+c(H+),故C项正确;
= 10-4.2在pH=7的溶液c(A2-)接近0.1 mol/L,c(H+)=10-7 mol/L,带入上述平衡常数表达式可得c(HA-) = 10-3.8> c(H+),根据电荷守恒规律又知c(Na+)=2c(A2-)+c(HA-),则c(Na+)>2c(A2-)+c(H+),故C项正确;
D. c(Na+)=0.150 mol·L-1的溶液中存在c(H2A)+c(HA-)+c(A2-)=0.100molL-1,则溶液中存在物料守恒2c(Na+)=3[c(H2A)+c(HA-)+c(A2-)]①,又存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)②,①-2×①得,2c(OH-)+c(A2-) =c(HA-)+3c(H2A) 2c(H+),故D项错误;
答案选AC。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某同学在研究新制饱和氯水成份的实验中,根据实验现象得出的结论不正确的是( )
A. 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有CI-
C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D. 向淀粉碘化钾溶液中滴加少量氯水,溶液变蓝,说明氯水中含有ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SO2![]() CaSO3
CaSO3![]() CaSO4
CaSO4
B. Fe![]() Fe2O3
Fe2O3![]() FeCl3
FeCl3
C. HCl(aq) ![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
D. Cu2(OH)2CO3![]() CuO
CuO![]() CuCl2(aq)
CuCl2(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T0 ℃时,在2 L的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1 ℃、T2 ℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1 ℃、T2 ℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是
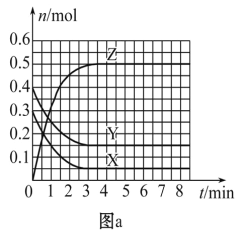
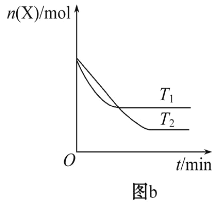
A. 该反应的正反应是吸热反应
B. T0 ℃,从反应开始到平衡时:v(X)=0. 083 mol·L-1·min-1
C. 图a中反应达到平衡时,Y的转化率为37. 5%
D. T1℃时,若该反应的平衡常数K=50,则T1<T0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,CO和CO2的混合气体共28L,质量为51g。其中CO2的质量为_____g,混合气体中CO的物质的量分数为____。混合气体的平均摩尔质量为_______。
(2)同温同压下,同质量的NH3和H2S气体体积比为______,原子个数之比为______,密度之比为________。
(3)在120℃时分别进行如下四个反应(除S外其它物质均为气体):
A.2H2S+O2=2H2O+2S↓ B.2H2S+3O2=2H2O+2SO2
C.C2H4+3O2=2H2O+2CO2 D.C4H8+6O2=4H2O+4CO2
若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是___________;符合d前>d后和V前>V后的是___________(填写反应的代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:
则下列叙述错误的是( )
A. A气体是NH3,B气体是CO2
B. 把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉
C. 纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中
D. 第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:下列说法不正确的是( )
实验编号 | 温度 | 催化剂用量(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4溶液褪色平均时间 min | ||
体积(mL) | 浓度mol·L-1 | 体积(mL) | 浓度 mol·L-1 | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
A. a<12.7,b>6.7
B. 用KMnO4表示该反应速率,v(实验3)<v(实验1)
C. 用H2C2O4表示该反应速率,v(实验1)约为7.87×10-5 mol·L-1·min-1
D. 可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。


(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,左图为其工作原理,右图为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是
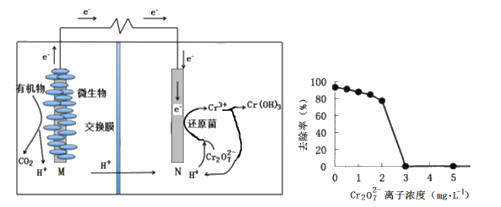
A. 有机物被氧化,M为电源负极
B. 电池工作时,N极附近溶液pH增大
C. Cr2O72-离子浓度较大时,可能会造成还原菌失活
D. 处理0.1 mol Cr2O72-时有1.4 mol H+从交换膜左侧向右侧迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com