
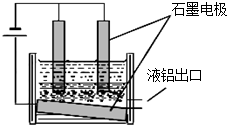
 元素铝是在生产、生活中应用广泛的金属元素.
元素铝是在生产、生活中应用广泛的金属元素.分析 (1)矿石与NaOH溶液高温反应,然后降温析出晶体,再经净化和高温煅烧得到氧化铝,说明析出晶体为Al(OH)3;
(2)氧化铝熔点高难于熔融电解,生产中加入冰晶石(Na3AlF6),降低氧化铝熔点,利于熔融电解;
①电解过程中阴极上铝得到电子生成铝;
②电解氧化铝阳极上是氧离子失电子发生氧化反应生成氧气,氧气和电极石墨反应生成二氧化碳损耗电极;
(3)依据铝离子水解显酸性,四羟基合铝酸根离子水解 显碱性,混合后水解相互促进生成氢氧化铝沉淀;
(4)A、依据化合物元素化合价代数和为0分析计算;
B、它用于净化水时对水的pH的改变,比相同量的AlCl3和FeCl3都大;
C、这种碱式盐可看做FeCl3、AlCl3水解的中间产物;
D、它在强酸性和强碱性溶液中都不能稳定存在.
解答 解:(1)矿石与NaOH溶液高温反应,然后降温析出晶体,再经净化和高温煅烧得到氧化铝,说明析出晶体为Al(OH)3;矿石中氧化铝溶于氢氧化钠溶于生成四羟基合铝酸钠高温分解生成氢氧化铝和氢氧化钠,析出晶体的反应为NaAl(OH)4=Al(OH)3↓+NaOH,
故答案为:NaAl(OH)4=Al(OH)3↓+NaOH;
(2)氧化铝熔点高难于熔融电解,生产中加入冰晶石(Na3AlF6),降低氧化铝熔点,利于熔融电解,降低氧化铝熔点,使其在1000℃左右即可熔化,
故答案为:作助熔剂;
①电解过程中阴极上铝得到电子生成铝;电极反应为:Al3++3e-=Al,故答案为:Al3++3e-=Al;
②电解氧化铝阳极上是氧离子失电子发生氧化反应生成氧气,氧气和电极石墨反应生成二氧化碳,电极石墨不断被消耗,所以需要不断补充石墨电极,
故答案为:电解阳极产生O2,在高温条件下,石墨阳极被不断的氧化为CO2;
(3)A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,说明溶液呈酸性是因为Al3+水解,溶液呈碱性为NaAl(OH)4溶液水解显碱性;混合后水解相互促进反应生成氢氧化铝沉淀;反应的离子方程式为:Al3++3[Al(OH)4]-=4Al(OH)3↓,
故答案为:Al3++3[Al(OH)4]-=4Al(OH)3↓;
(4)A、阴离子总价态:6-n+n=6,铝只有+3价,所以Fe就是6-3=3,外面的m只是表示这样一个分子聚合度,与价态无关,故A错误;
B、PAFC用于净水时,氢氧根离子的存在对水的电离期待抑制作用,比用相同量的氯化铝和氯化铁对水的pH改变小,故B正确;
C、PAFC是碱式复盐可看作一定比例的氯化铁与氯化铝水解的中间产物,故C正确;
D、PAFC是碱式复盐,在强酸性和强碱性溶液中都不能稳定存在,故D错误;
故答案为:BC.
点评 本题考查了电解原理的应用分析,电解过程的反应判断,电极书写方法,化合物组成结构的理解和性质的判断,题目难度中等.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCl2中既含有离子键又含有共价键 | |
| B. | Na0H中既含有离子键又含有共价键 | |
| C. | Na2O2中只含有离子键 | |
| D. | 由非金属元素组成的物质NH4Cl中只有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
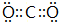 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.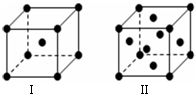
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有Fe3+ |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
| C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰颜色为紫色 | 原溶液中一定只含K+ |
| D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子方程式 | 评价 |
| A.亚磷酸是一种二元酸,在其中加入过量的烧碱溶液: H3PO3+3OH-=PO33-+3H2O | 正确 |
| B.在亚硫酸中加入少量的次氯酸钠溶液 H2SO3+ClO-=Cl-+2H++SO42- | 正确 |
| C.在碳酸氢镁溶液中加入过量氢氧化钠溶液: Mg2++2HCO3-+2OH-=Mg CO3↓+CO32-+2H2O | 错误:生成物应是 Mg(OH)2和Na2CO3 |
| D.在过氧化钠中加入稀硫酸: 2Na2O2+4H+=4Na++2H2O+O2↑ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O中含有的质子数目为10NA | |
| B. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- | |
| C. | 氢氧燃料电池工作时,若负极反应0.5g H2时,则正极反应的O2的体积(折算为标况)是2.8L | |
| D. | 22.4LNH3分子中含有的共价键数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com